17341-24-1
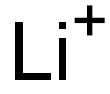 17341-24-1 结构式
17341-24-1 结构式
基本信息
英文别名
LITHIUM IONLithiumcation
Lithium ion (1+)
Lithium, ion (Li1+)
LITHIUM ION STANDARD
LITHIUM ION CHROMATOGRAPHY STANDARD
LITHIUM, ION CHROMATOGRAPHY STANDARD SOLUTION
所属类别
无机化工:金属氯化物及盐常见问题列表
概述
锂是最轻的金属(比重0.534)。1817年由J.A.阿弗韦聪发现。锂的元素符号为Li。原子量6.941(2)。原子序数3。银白色稀有软及最轻金属。熔点179℃,沸点1317℃,相对密度0.534,硬度0.6。化学性质极活泼,可直接与氢、氧、氮气化合。与水、酸激烈反应放出氢气。空气中极易被氧化变暗,空气中燃烧发出浅蓝色火焰,反应极其猛烈、危险,蒸气火焰呈红色。锂应贮存在煤油、液体石蜡、汽油或惰性气体中。在自然界中主要以锂辉石、锂云母及磷铝石矿的形式存在,也存在于某些地区的盐湖中。化学性质
锂的电子构型为(He)2s1。与其他碱金属不同,金属锂在室温下与水反应较慢,但能与氮气反应生成黑色的一氮化三锂Li3N晶体。锂的氧化态为+1。在碱金属离子中,锂离子半径特别小(0.60埃),水合倾向非常大,水合能高达-519千焦/摩尔,水合离子半径最大(3.40埃)。锂盐在水中的溶解度与镁盐相似,与其他碱金属盐不同,锂的弱酸盐如氟化锂LiF、碳酸锂Li2CO3和磷酸锂Li3PO4都难溶于水。在碱金属氯化物中,只有氯化锂易溶于有机溶剂中。利用这种性质,可从其他碱金属氯化物中分离氯化锂,再转变为硫酸盐,以定量测定锂。锂的挥发性盐的火焰呈深红色,可以此定性检定锂。制备方法
锂可从锂辉石提取。首先将锂辉石在1100℃下加热,使天然的α锂辉石转变为粉末状的易被酸浸蚀的β锂辉石,然后用过量的浓硫酸在250℃下焙烧,用冷水浸取焙烧混合物,得到硫酸锂溶液,再加入碳酸钠,沉淀出碳酸锂。金属锂常用电解熔融的氯化锂和氯化钾混合物法来制备。用途
无水氯化锂主要应用于熔盐电解生产金属锂的原料,同时还应用于铝的焊接剂、空调除湿剂、特种水泥生产及高分子材料聚苯硫醚的催化剂等领域。储存
锂应贮存在煤油、液体石蜡、汽油或惰性气体中。
存在形式
锂在自然界中主要以锂辉石、锂云母及磷铝石矿的形式存在,也存在于某些地区的盐湖中。