【背景及概述】[1][2][3]
碳酸钠化学式Na2CO3,又叫做纯碱,俗称苏打。无水碳酸钠是白色粉末或细粒,加热至851℃时熔化而不分解,相对密度为2.532。易溶于水,溶解时放热; 由于它是强碱弱酸盐,在水中高度水解,其水溶液呈强碱性。碳酸钠常以水合物形式存在,可以有几种水合物: 一水物Na2CO3·H2O,七水物Na2CO3·7H2O和十水物Na2CO3·10H2O。日常的食用碱主要是十水碳酸钠,俗名洗涤碱或晶碱。它存在于我国内地的盐碱湖中,天冷低温时,湖面上析出大块晶体,叫做天然碱。透明晶状的十水碳酸钠在干燥空气中易失去结晶水而变为粉末,主要转变成一水碳酸钠。碳酸钠水溶液与水解性强的金属离子作用时,由于水解互相促进,最后得到的是碱式碳酸盐或氢氧化物的沉淀。它吸湿性很强,吸湿后可结成硬块,能从潮湿空气中逐渐吸收二氧化碳,而成为碳酸氢钠。碳酸钠是化学工业中的重要产品之一,用途广泛,是玻璃、造纸、肥皂、洗涤剂、纺织、制革、石油、染料、食品等工业的重要原料。
在冶金工业中用作助熔剂,在水的净化中用作软化剂,还可作为机械零件表面的去油剂,以及用来制取钠和其他化合物。无水碳酸钠作为基准试剂,在各行各业的化学分析中被广泛应用。目前制备无水碳酸钠的方法是:将工业无水碳酸钠溶解于热蒸馏水中,然后将其水溶液过滤后浓缩,便得到所用的基准试剂无水碳酸钠。这种方法只能将工业无水碳酸钠中不溶于水的杂质除去,而不能除去工业无水碳酸钠中所含的Mg2+、Ca2+和Fe2+,致使在进行化学分析时所得到的检测精度受到影响,进而可能导致检验结果的错误;同时,应为长时间浓缩碳酸钠溶液,使得无水碳酸钠成品澄清度不高,致使产品合格率较低。
【应用】[4]
碳酸钠是重要的化工基本原料,主要用途有:①生产各种玻璃。在玻璃原料中作为玻璃调整剂或熔剂,使石英砂(玻璃形成体)中Si-O键断裂而易熔,并降低粘度,增大膨胀系数。②化工原料。例如与石英砂反应制硅酸钠(水玻璃(),用于制备各种难溶碳酸盐,用于制漂白剂、洗涤剂、催化剂、染料,以及作为矿石加工试剂。③在冶金工业中用来脱除硫和磷,并用作助熔剂。此外还用于造纸、制肥皂、制耐火材料和釉料,净化水,以及在实验室中用作碱性熔剂。在生产上纯碱可代替氢氧化钠来中和酸:
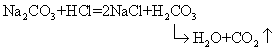
碳酸钠能形成含不同水分子数的结晶水合物。十水碳酸钠又称晶碱或洗涤碱,溶于水时吸热,在空气中易风化而失去结晶水。主要用作洗涤碱,适用于洗涤纺织品,并用作棉和亚麻的漂白剂。一水碳酸钠是最稳定的碳酸钠,商名碳氧,作为显影剂组分用于照相业。
【制备】[1][2]
方法1:一种无水碳酸钠的制备方法,其特征在于:制备方法的步骤包括:
1)将工业碳酸钠溶于水制成工业碳酸钠水溶液,用氢氧化钠调该工业碳酸钠水溶液Ph值至13~14,搅拌加热至55~65℃,反应0.5~1.5小时,保温1.5~2.5小时后,过滤得去Mg2+、Ca2+碳酸钠水溶液;
2)在去Mg2+、Ca2+碳酸钠水溶液中加入双氧水,保温22~24小时后,过滤得去Fe2+碳酸钠水溶液;
3)向去Fe2+碳酸钠水溶液中通入CO2达饱和,得到有碳酸氢钠沉淀析出的碳酸氢钠水溶液;
4)吸滤碳酸氢钠水溶液,得到碳酸氢钠结晶;
5)将碳酸氢钠结晶水洗后,脱水,将脱水后的碳酸氢钠结晶干燥,即得基准试剂无水碳酸钠成品。
方法2:一种高纯无水碳酸钠的制备方法,其特征在于:方法如下:
1)溶解无水碳酸钠:
将工业纯无水碳酸钠慢慢加入蒸馏水不锈钢桶中,不断搅拌测其相对密度为1.16~1.18g/mL,得溶液A;
2)制得结晶碳酸钠:
将分析纯乙醇放入不锈钢盆内,盆上放置活性炭及纯度低的过滤筛,然后将A溶液慢慢倒入筛中过滤,滤液流入乙醇盆中,不断搅拌,自然冷却直至碳酸钠析出,抽滤干燥得到碳酸钠B;
3)制得高纯无水碳酸钠:
将步骤(2)得到的B置于聚乙烯塑料桶中,加入蒸馏水搅拌溶解,将溶液用布氏漏斗过滤,将滤液量于铂金蒸发皿中,加热蒸发,加热搅拌180℃~200℃,至析中结晶,趁热用不锈钢离心机甩干,将晶体置于铂金蒸发皿中于马弗炉上加热,不断翻动,至失去水分,移入真空干燥器,冷却干燥,即得高纯无水碳酸钠。
【主要参考资料】
[1] 张为玲.无水碳酸钠的制备方法. CN200810151994.1,申请日2008-10-06
[2] 胡建华.一种高纯无水碳酸钠的制备方法 . CN201010229244.9 ,申请日2010-07-17
[3] 中国中学教学百科全书·化学卷
[4] 科学技术社会辞典·化学
