

其它 米拉贝隆杂质64 相关介绍米拉贝隆
药品概述 注意事项 安全用药
功效作用
本品用于成年膀胱过度活动症(OAB)患者尿急、尿频和/或急迫性尿失禁的对症治疗。
用法用量
本品不同剂型、不同规格的用法用量可能存在差异,请阅读具体药物说明书使用,或遵医嘱。
米拉贝隆缓释片:
1、成年患者(包括老年患者):推荐剂量为50mg,每日一次,餐后服用。用水送服。由于本品是缓释片,应整片吞服,不得咀嚼、掰开或压碎。
2、特殊人群:
(1)肾和肝损伤:在终末期肾病(GFR<15ml/min/1.73m2或需要进行血液透析的患者)或重度肝损伤(Child-Pugh分级C级)患者中未进行过本品研究,因此不推荐上述患者使用本品(详细参见【注意事项】、【药代动力学】项下)。
(2)性别:不需要依据性别调整剂量。
(3)儿童患者:18岁以下儿童使用本品的安全性和有效性尚未明确。目前尚无相关数据。
药品类型
处方药 西药 非医保
参考价格
116.00元-1160.00元
商品名称
贝坦利
常见规格
米拉贝隆缓释片:(1)25mg。(2)50mg。
贮藏方式
密封,10-30℃保存。
封宇飞
| 主任药师 药剂科
北京大学人民医院 三级甲等
注意事项
1、肾损伤患者:在终末期肾病(GFR<15ml/min/1.73m2或需要进行血液透析)患者中未进行过本品研究,因此不推荐上述患者使用本品。重度肾损伤(GFR15-29ml/min/1.73m2)患者用药数据有限;基于一项药代动力学研究(参见【药代动力学】项下)结果,建议该类患者剂量降至25mg。重度肾损伤(GFR15-29ml/min/1.73m2)患者如正在使用强CYP3A抑制剂,则不推荐使用本品(参见【药物相互作用】项下)。
2、肝损伤患者:在重度肝损伤(Child-Pugh分级C级)患者中未进行过本品研究,因此不推荐该类患者使用本品。中度肝损伤(Child-Pugh分级B级)患者如正在使用强CYP3A抑制剂,则不推荐使用本品(参见【药物相互作用】项下)。
3、高血压患者:米拉贝隆可能升高血压,故应在基线及治疗期间定期监测血压,特别是对于高血压患者。中度高血压(收缩压≥160mmHg或舒张压≥100mmHg)用药患者的数据有限。
4、先天性或后天性QT间期延长患者:临床试验中,治疗剂量的本品没有引起临床相关的QT间期延长(参见【药理毒理】项下)。但是由于上述试验排除了已知有QT间期延长病史的患者或正在接受已知可延长QT间期药物治疗的患者,因此尚不清楚本品对上述患者的影响。上述患者使用本品时应谨慎。
5、膀胱出口梗阻患者和服用抗毒蕈碱药物治疗OAB患者:米拉贝隆上市后用药经验中有膀胱出口梗阻患者(BOO)和服用抗毒蕈碱药物治疗的OAB患者发生尿潴留的报道。一项对照、安全性临床研究中,未显示出膀胱出口梗阻患者服用米拉贝隆会增加尿潴留的风险,对于临床上显著的膀胱出口梗阻患者,建议谨慎使用米拉贝隆。服用抗毒蕈碱药物治疗OAB的患者也应谨慎使用米拉贝隆。
6、血管性水肿:有报告显示,服用米拉贝隆后出现脸、唇、舌和/或喉血管性水肿。有一些患者首剂量服用后出现,也有个例报告显示首剂量服用后几小时或多剂量服用后出现血管性水肿。血管性水肿相关的上呼吸道肿胀可能是致命的。如果舌、下咽部、喉发生血管性水肿,应立即停用米拉贝隆,采取适当治疗措施以确保患者呼吸道通畅。
7、接受CYP2D6代谢药物治疗的患者:由于米拉贝隆是CYP2D6的中度抑制剂,美托洛尔和地昔帕明等CYP2D6底物与米拉贝隆联用时全身暴露增加,因此有必要进行适当监测并调整剂量,特别是与硫利达嗪、氟卡尼和普罗帕酮等经CYP2D6代谢的治疗指数窄的药物联用时。
8、孕妇及哺乳期妇女用药:
妊娠期妇女:妊娠C类药物。本品尚未在孕妇中进行充分的对照试验,仅可在权衡对孕妇的益处大于对孕妇和胎儿风险时可以使用本品,治疗期间怀孕的妇女应向医生咨询。动物实验数据:
(1)根据动物实验数据,预计米拉贝隆使不良发育结局风险升高的可能性较小。可逆性不良发育结局包括大鼠骨化延迟和波状肋骨以及家兔胎仔体重降低,分别发生于暴露水平大于或等于最大人用推荐剂量(MRHD)的22倍和14倍时。母体毒性暴露可降低大鼠和家兔胎仔体重,并有家兔胎仔死亡、主动脉扩张以及心脏肥大的报告。
(2)大鼠胚胎/胎仔发育毒性实验中,每天经口给予妊娠动物(妊娠第7天至第17天,从着床至胎仔硬腭闭合期间)米拉贝隆0、10、30、100或300mg/kg。根据AUC判断,母体动物全身暴露约比妇女MRHD(50mg)下的AUC高0、1、6、22或96倍。当大鼠的暴露达到人使用MRHD(50mg)后全身暴露的6倍,未见胚胎/胎仔毒性。全身暴露等于或大于人MRHD剂量全身暴露的22倍时,胎仔骨化延迟和波状软骨的发生率升高。上述变化可逆。
(3)家兔胚胎/胎仔发育毒性实验中,每天经口给予妊娠动物(妊娠第6天至第20天,从着床至胎仔硬腭闭合期间)米拉贝隆0、3、10或30mg/kg。根据AUC判断,动物母体全身暴露约为妇女MRHD(50mg)下的AUC高0、1、14或36倍。根据全身暴露达到人体MRHD剂量下全身暴露14倍时发生胎仔体重降低,确立兔胚胎/胎仔未观察到临床不良反应的剂量水平(NOAEL),与人体MRHD剂量下的暴露水平接近。剂量升高时,全身暴露为MRHD剂量下人体暴露的36倍时,母体增重减缓,摄食量减少,17只妊娠家兔中有1只死亡,胎仔死亡发生率升高,并有胎仔发生主动脉扩张和心脏肥大的报告。
(4)自妊娠第7天起至分娩后20天期间,以0、10、30或100mg/kg/天的剂量对妊娠大鼠给药,评估米拉贝隆对出生前和出生后发育的影响。根据AUC判断,母体全身暴露是妇女MRHD剂量下人体暴露的0、1、6和22倍。母体全身暴露为MRHD剂量的6倍时,经宫内暴露和21天哺乳暴露于米拉贝隆的大鼠幼仔中无可见不良反应发生。暴露水平为MRHD剂量下的22倍时,出生后第4天幼仔存活率(92.7%)相比对照组(98.8%)发生微小但有统计学意义的降低,但出生后21天时的幼仔存活率不受影响。出生当日幼仔的绝对体重不受影响。以30mg/kg剂量(人体MRHD剂量下暴露的22倍)用药时,从出生后第4天至第7天幼仔增重降低5%-13%,但此后哺乳期间没有降低。暴露水平达到MRHD剂量下的22倍时,宫内暴露和经乳汁暴露不影响子代的行为或生殖能力。
哺乳期妇女:尚不清楚本品是否可分泌至人乳汁。大鼠乳汁中米拉贝隆的浓度为母体血药浓度的2倍。哺乳期幼仔的肺、肝和肾中可检测到米拉贝隆。尚未进行试验评估本品对人乳汁分泌的影响、经人乳汁的分泌或其对哺乳期婴儿的影响。由于预计本品可分泌至人乳汁,并且哺乳期婴儿有可能发生严重不良反应,应考虑药物对母体的重要性,决定停止哺乳或停止用药。
9、儿童用药:18岁以下儿童使用本品的安全性和有效性尚未明确。目前尚无相关数据。
10、老年用药:老年志愿者(≥65岁)多次口服给药后,米拉贝隆及其代谢物的最大血药浓度(Cmax)和药物浓度-时间曲线下面积(AUC)与年轻志愿者(18-45岁)相似。因此无需调整剂量。
11、药物过量:健康志愿者接受米拉贝隆单次最高剂量达到400mg。该剂量水平报告的不良事件包括心悸(1例/6例)和脉率升高至100次/分钟以上(bpm)(3例/6例)。健康志愿者多次服用米拉贝隆(剂量达到每天300mg,共10天),脉率和收缩压升高。用药过量的症状可能包括心跳加快、脉率升高或血压升高。用药过量的治疗包括对症和支持治疗。如果发生用药过量,应监测脉率、血压和心电图。
禁忌症
米拉贝隆禁用于以下患者:
1、对米拉贝隆或本品的任何辅料过敏者。
2、控制不佳的重度高血压(收缩压≥180mmHg和/或舒张压≥110mmHg)患者。
不良反应
全球安全性总结:
1、在Ⅱ/Ⅲ期临床试验中对8433例OAB患者进行了米拉贝隆的安全性评价,其中5648例患者至少服用一次米拉贝隆,622例患者接受米拉贝隆治疗至少1年(365天)。大多数不良反应为轻到中度。
2、在三项为期12周的双盲、安慰剂对照的Ⅲ期临床试验中,88%的患者完成了米拉贝隆治疗,4%的患者由于不良事件停药。用米拉贝隆50mg治疗的患者最常见的不良反应为尿路感染和心动过速;尿路感染发生率为2.9%,没有患者因尿路感染而停药;心动过速发生率为1.2%,0.1%的患者由于心动过速停药。严重不良反应包括房颤(0.2%)。3、在为期1年的长期阳性对照(毒蕈碱受体拮抗剂)临床试验期间发生的不良反应类型和严重程度与三项为期12周的双盲、安慰剂对照Ⅲ期临床试验相似。4、不良反应列表:三项为期12周的双盲、安慰剂对照Ⅲ期临床试验期间观察到的米拉贝隆不良反应见下表。不良反应发生率定义如下:十分常见(≥1/10);常见(≥1/100,<1/10);偶见(≥1/1,000,<1/100);罕见(≥1/10,000,<1/1,000);十分罕见(<1/10,000)。各发生率组内,不良反应按严重性降序排列见下表。
(1)感染及侵染类疾病:常见-尿路感染;偶见-阴道感染、膀胱炎。
(2)精神类疾病:未知-失眠*。
(3)眼器官疾病:罕见-眼睑水肿。
(4)心脏器官疾病:常见-心动过速;偶见-心悸、房颤。
(4)血管与淋巴管类疾病:十分罕见-高血压危象*。
(5)胃肠系统疾病:常见-恶心*、便秘*、腹泻*;偶见-消化不良、胃炎;罕见-唇部水肿。
(6)皮肤及皮下组织类疾病:偶见-荨麻疹、皮疹、斑状皮疹、丘疹样皮疹、瘙痒;罕见-白细胞破裂性血管炎、紫癜、血管性水肿*。
(7)各种肌肉骨骼及结缔组织疾病:偶见-关节肿胀。
(8)生殖系统及乳腺疾病:偶见-外阴阴道瘙痒。
(9)各类检查:偶见-血压升高、谷氨酰转移酶增加、天门冬氨酸转氨酶增加、丙氨酸氨基转移酶增加。
(10)肾脏及泌尿系统疾病:罕见-尿潴留*。
(11)神经系统疾病:常见-头痛*、头晕*。
*上市后用药观察到的。
名词解释
米拉贝隆(Mirabegron)用于膀胱过度活动症的选择性β3-肾上腺素能受体激动剂。
英文
YM 178;Mirabegron;N-(4-(2-(2-hydroxy-2-phenylethylamino)ethyl)phenyl)-2-(2-aminothiazol-4-yl)acetamide;2-AMino-N-[4-[2-[[(2R)-2-hydroxy-2-phenyl-ethyl]aMino]-ethyl]phenyl]-4-thiazoleacetaMide;4-Thiazoleacetamide, 2-amino-N-(4-(2-(((2R)-2-hydroxy-2-phenylethyl)amino)ethyl)phenyl)-;2-(2-aMino-1,3-thiazol-4-yl)-N-(4-{2-[(2-hydroxy-2-phenylethyl)aMino]ethyl}phenyl)acetaMide;(2R)-2-(2-AMinothiazol-4-yl)-4'-[2-[(2-hydroxy-2-phenylethyl)aMino]ethyl]acetic Acid Anilide
适应症
用于治疗膀胱过度活动引起的尿急、尿频及尿失禁。
有两种已知晶型(α晶型和β晶型)。
杂质、分离纯化业务介绍
桐晖药业公司成立20多年,提供原料/参比制剂的同时,拥有一个高水平的合成定制和分离纯化团队、提供高难度定制合成和分离纯化服务,建立了完善的杂质分离技术平台,可以快速的帮您得到所需的杂质纯品,特别擅长高难度的微量杂质标样制备,比如(万分之一等极低含量,溶解度差,稳定性差,分离度差,保留弱,发酵类药物杂质),可以提供合理的监测和控制方法,分离和纯化其过程中产生的微量未知杂质。帮您轻松解决杂质研究的难题。严格把控质量关,配套资质齐全,所有杂质均可提供COA。现除自有高端定制品牌TOREF外,也代理了包括中检所、BP、USP、EP、TLC 、LGC、TRC等品牌的销售,品类齐全,价格有竞争力。
专业分离纯化制备服务(高难度项目解决方案):
1、含量低
2、分离度差
3、稳定性差
4、溶解性差
5、保留弱
6、无紫外吸收
我们的优势:
1、专业团队,完善的平台,分离纯化技术成熟,经验丰富
2、药物研发和注册过程中所需的相关杂质的定制合成
3、药物研究多成分粗品,提供分离纯化和结构解析
4、擅长分离低含量,分离度差,无紫外吸收的成分
5、多种分离技术组合,周期短,成功率高,价格优
6、毫克级,克级,公斤级纯化、技术转让
7、提供完整的资料COA等相关检测数据满足申报要求
8、快速高效交付,品质高,售后服务质量好
成功案例对卡磺钠注射液多个杂质分离纯化,确定结构,帮助客户解决生产难题
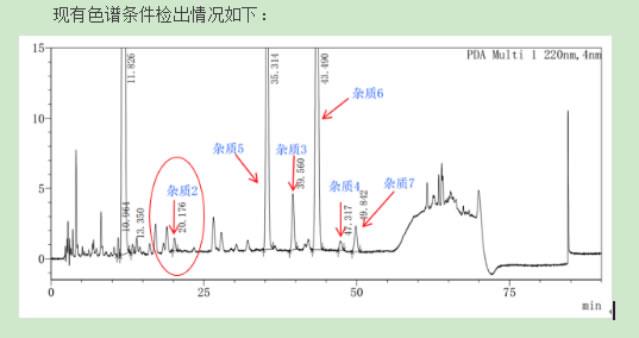
桐晖药业,基于核磁、色谱及其联用技术,在分离纯化、结构确证细分领域潜心钻研十余载,现为您提供技术专属性强、纯度高、重现性好、结构确证无误的专业解决方案,助力药品研发。
关键字: 米拉贝隆杂质64;米拉贝隆杂质64杂质;米拉贝隆杂质64对照品;米拉贝隆杂质64杂质制备;2416733-26-9;
广州市桐晖药业有限公司成立于1999年,国家GSP认证,主要经营中西药制剂及化学原料、医药化工原料和医药中间体等产品。桐晖拥有雄厚的经济实力,是一家集市场营销、学术推广、进出口、新产品研发、合作生产为一体的现代企业。
桐晖药业是行业中的进口药专家,积极快速引进国外战略性新产品,尤其是国内紧缺或空白的新产品,已与全球各大药企建立深入的合作关系,致力于将国际上最新、最好的产品引入中国市场,打造中国医药行业排头兵。
桐晖药业是世界新产品进出口的专业平台,在国际医药界享有很高的名望和美誉。它拥有一支专业的营销部、市场部和进口注册团队,具有专业的产品打造力,高度准确的终端占有力,打造同类产品中的优秀品