


历史发展
盐酸乌拉地尔注射液由德国奈科明有限公司(后被武田制药有限公司收购)开发,在1988年,其分别在法国、德国上市。2001年12月,原研进口产品在中国上市。 [7]
2018年,乌拉地尔加入基药目录。 [8]
药品简介
适应症
注射用盐酸乌拉地尔、盐酸乌拉地尔注射液、乌拉地尔注射液:用于治疗高血压危象(如血压急聚升高),重度和极重度高血压,以及难治性高血压。用于控制围手术期高血压。
乌拉地尔缓释片:用于原发性高血压,肾性高血压及嗜铬细胞瘤引起的高血压的治疗。
乌拉地尔缓释胶囊:用于原发性高血压、肾性高血压、有褐色细胞瘤所引发的高血压。伴有前列腺肥大症的排尿障碍。
用法用量
本品不同剂型、不同规格的用法用量可能存在差异,请阅读具体药物说明书使用,或遵医嘱。
注射用盐酸乌拉地尔、盐酸乌拉地尔注射液、乌拉地尔注射液:
1、静脉注射:缓慢静注10-50mg,监测血压变化,降压效果应在5分钟内即可显示。若效果不够满意,可重复用药。
2、持续静脉点滴或用输液泵:本品在静脉注射后,为了维持其降压效果,可持续静脉点滴。液体按下述方法配制:通常将250mg乌拉地尔加入到合适的液体中,如生理盐水、5%或10%的葡萄糖、5%的果糖或右旋糖酐40加0.9%的氯化钠溶液中,如使用输液泵维持剂量,可加入100mg乌拉地尔,再用上述液体稀释到50mL。
3、静脉输液的最大药物浓度为每毫升4mg乌拉地尔。
4、输入速度根据病人的血压酌情调整。推荐初始速度为每分钟2mg,维持速度为9mg/h。(若将250mg乌拉地尔溶解在500ml液体中,则1mg乌拉地尔相当于44滴或2.2ml输入液)。静脉点滴或用输液泵输入应当在静脉注射后使用,以维持血压稳定。
5、血压下降的程度由前15分钟内输入的药物剂量决定,然后用低剂量维持。疗程一般不超过7天。
乌拉地尔缓释片:
成年人服用乌拉地尔通常从30mg/天开始,当效果不明显时,可在1-2周的时间内逐渐增加剂量至每天60mg或120mg,分两次口服,并可根据年龄、症状做适当增减。
乌拉地尔缓释胶囊:
1、原发性高血压、肾性高血压、有褐色细胞瘤所引发的高血压。通常在成年人中,乌拉地尔给药由1日30mg(1粒)开始,如果效果不明显,可在1-2周的间隔下逐渐增加到1日120mg(4粒),并分为一日2次径口给药。另外,根据年龄和症状,可适当的增减给药量。
2、伴有前列腺肥大症的排尿障碍。乌拉地尔给药由1日30mg(1粒)开始,如果效果不明显,可在1-2周的间隔下逐渐增加到1日60-90mg(2-3粒),并分为一日2次径口给药。另外,根据年龄和症状,可适当的增减给药量,但一天的最高给药量为90mg(3粒)。
不良反应
注射用盐酸乌拉地尔、盐酸乌拉地尔注射液、乌拉地尔注射液:
1、使用本品后,病人可能出现下列不良反应:头痛、头晕、恶心、呕吐、出汗、烦躁、乏力、心悸、心率不齐、心动过速或过缓、上胸部压迫感或呼吸困难等症状,其原因多为血压降得太快所致,通常在数分钟内即可消失,一般无须中断治疗。
2、过敏反应(如骚痒、皮肤发红、皮疹等)少见。
3、偶见因变换姿势而造成的血压下降。
4、极个别病例在口服本药时出现血小板计数减少,但血清免疫学研究尚未证实其因果关系。
禁忌
1、禁用于对本品成分过敏的患者。
2、主动脉峡部狭窄或动静脉分流的患者禁用(肾透析时的分流除外)。
3、哺乳期妇女禁用。
注意事项
1、驾车或操作机器者应慎用。
2、应避免与洒精类饮料合用。
3、高龄及肝功能障碍患者应慎用。
4、本品与其他降压药合用,可增强降压作用。同时服用西米替丁,会提高本品的血药浓度。
5、因本品为缓释制剂,因此不宜咀嚼或咬碎服用,以防止一过性血药浓度上升。
药物相互作用
若同时使用其他抗高血压药物,饮酒或病人存在血容量不足的情况,如腹泻、呕吐、可增强本品的降压作用,同时应用西咪替丁,可使本品的血药浓度上升,最高达15%。
药理作用
乌拉地尔是一种高选择性α受体阻滞剂,具有外周和中枢双重作用。外周扩张血管作用主要为阻断突触后α1受体,使外周阻力显著下降,同时也有中等程度的阻断儿茶酚胺的收缩血管的作用。中枢作用则通过激活5-羟色胺-1A受体,降低延髓心血管中枢的交感反馈调节而起降压作用,同时无反射性心率加快的副作用,还可改善血流动力学各项指标。
药代动力学
注射剂:静脉注射乌拉地尔后,在体内分布呈二室模型,分布相半衰期约为35分钟。分布容积0.8(0.6-1.2)L/Kg。血浆清除半衰期2.7(1.8-3.9)小时,蛋白结合率80%。50-70%的乌拉地尔通过肾脏排泄,其余由胆道排出。排泄物中约10%为药物原形,其余为代谢物。主要代谢物为无抗高血压活性的药物羟化形式。
口服固体制剂:健康志愿者单次口服本品30mg,约3小时后血药浓度达到峰值(约300ng/ml)。本品在体内的主要代谢产物为乌拉地尔的羟基体、O-脱甲基体、脲嘧啶N-脱甲基体等。在体内,50-70%的原药及其代谢产物通地肾脏排泄,其余的通过粪便排出体外。
药典信息
基本信息
本品为6-[[3-[4-(2-甲氧基苯基)-1-哌嗪]苯基]氨基]-1,3-二甲基尿嘧啶,按干燥品计算,含C20H29N5O3不得少于99.0%。
性状
本品为白色结晶或结晶性粉末,无臭 。
本品在三氯甲烷中易溶,在甲醇或乙醇中溶解,在丙酮中略溶,在石油醚或水中不溶,在0.1mol/L盐酸溶液中略溶。
鉴别
1、取本品约50mg,加丙二酸约30mg与醋酐0.5mL,在80-90°C水浴中加热10分钟,应显红棕色。
2、取本品,加甲醇溶解并稀释制成每1mL中含8µg的溶液,照紫外-可见分光光度法(通则0401)测定,在268nm的波长处有最大吸收。
3、本品的红外光吸收图谱应与对照的图谱(光谱集910图)一致。
检查
溶液的澄清度与颜色
取本品0.5g,加0.1mol/L盐酸溶液25mL,溶液应澄清无色。
有关物质
照高效液相色谱法(通则0512)测定。
供试品溶液:取本品适量,加流动相溶解并稀释制成每1mL中含1mg的溶液。
对照溶液:精密量取供试品溶液1mL,置200mL量瓶中,用流动相稀释至刻度,摇匀。
系统适用性溶液:取乌拉地尔和杂质I对照品适量,加流动相溶解并稀释制成每1mL中分别含乌拉地尔0.1mg与杂质I0.01mg的混合溶液。
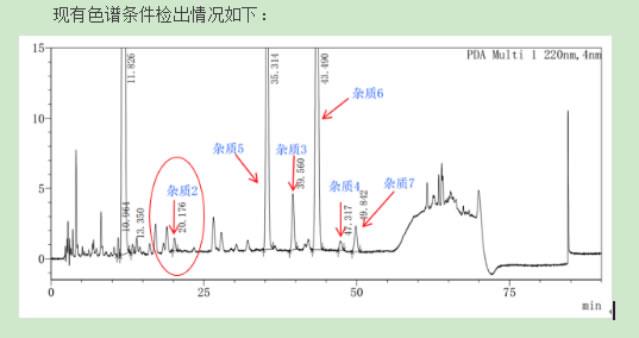
色谱条件:用十八烷基硅烷键合硅胶为填充剂,以醋酸钠溶液(取无水醋酸钠8.2g和冰醋酸40mL,加水溶解并稀释至600mL-甲醇(70:30)为流动相,检测波长为268nm,进样体积20µL。
系统适用性要求:系统适用性溶液色谱图中,乌拉地尔峰与杂质I峰的分离度应符合要求,理论板数按乌拉地尔计算不低于2000。
测定法:精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的2倍。
限度:供试品溶液色谱图中如有杂质峰,单个杂质峰面积不得大于对照溶液的主峰面积(0.5%),各杂质峰面积的和不得大于对照溶液主峰面积的2倍(1.0%)。
残留溶剂
照残留溶剂测定法(通则0861第一法)测定。
供试品溶液:取本品约1g,精密称定,置顶空瓶中,精密加入稀硫酸10mL,密封。
对照品溶液:精密称取1,2-二氯乙烷、乙醇、丙酮与苯各适量,加稀硫酸定量稀释制成每1mL中含1,2-二氯乙烷0.5µg、乙醇0.5mg、丙酮0.5mg和苯0.2µg的溶液,精密量取10mL,置顶空瓶中,密封。
色谱条件:以聚乙二醇为固定液的毛细管柱为色谱柱,柱温为80℃,检测器温度为200℃,进样口温度为200°C,顶空瓶平衡温度为85℃,平衡时间为30分钟。
系统适用性要求:对照品溶液色谱图中,各成分色谱峰间的分离度均应符合要求。
测定法:取供试品溶液与对照品溶液分别顶空进样,记录色谱图。
限度:按外标法以峰面积计算,1,2-二氯乙烷、乙醇、丙酮与苯的残留量均应符合规定。
干燥失重
取本品,在105°C干燥至恒重,减失重量不得过0.5%(通则0831)。
炽灼残渣
取本品1.0g,依法检查(通则0841),遗留残渣不得过0.1%。
重金属
取炽灼残渣项下遗留的残渣,依法检查(通则0821第二法),含重金属不得过百万分之二十。
含量测定
照高效液相色谱法(通则0512)测定。
供试品溶液
取本品约25mg,精密称定,置25mL量瓶中,加流动相溶解并稀释至刻度,摇匀,精密量取5mL,置50mL量瓶中,用流动相稀释至刻度,摇匀。
对照品溶液
取乌拉地尔对照品适量,精密称定,加流动相溶解并定量稀释制成每1mL中约含0.1mg的溶液。
系统适用性溶液、色谱条件与系统适用性要求
见有关物质项下。
测定法
精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图,按外标法以峰面积计算。
类别
抗高血压药。
贮藏
遮光,密封,在阴凉处保存。
制剂
乌拉地尔注射液。 [3]
相关专利
2009年7月1日,山东罗欣药业股份有限公司获得了“一种注射用盐酸乌拉地尔冻干粉及其制备方法”专利的授权。 [9]
2021年7月2日,河北一品制药股份有限公司获得了专利“一种盐酸乌拉地尔的制备方法”的授权。 [10]
2023年8月1日,石家庄四药有限公司获得了专利“一种乌拉地尔分散体缓释胶囊及其制备方法”的授权。 [11]
杂质、分离纯化业务介绍
桐晖药业公司成立20多年,提供原料/参比制剂的同时,拥有一个高水平的合成定制和分离纯化团队、提供高难度定制合成和分离纯化服务,建立了完善的杂质分离技术平台,可以快速的帮您得到所需的杂质纯品,特别擅长高难度的微量杂质标样制备,比如(万分之一等极低含量,溶解度差,稳定性差,分离度差,保留弱,发酵类药物杂质),可以提供合理的监测和控制方法,分离和纯化其过程中产生的微量未知杂质。帮您轻松解决杂质研究的难题。严格把控质量关,配套资质齐全,所有杂质均可提供COA。现除自有高端定制品牌TOREF外,也代理了包括中检所、BP、USP、EP、TLC 、LGC、TRC等品牌的销售,品类齐全,价格有竞争力。
专业分离纯化制备服务(高难度项目解决方案):
1、含量低
2、分离度差
3、稳定性差
4、溶解性差
5、保留弱
6、无紫外吸收
我们的优势:
1、专业团队,完善的平台,分离纯化技术成熟,经验丰富
2、药物研发和注册过程中所需的相关杂质的定制合成
3、药物研究多成分粗品,提供分离纯化和结构解析
4、擅长分离低含量,分离度差,无紫外吸收的成分
5、多种分离技术组合,周期短,成功率高,价格优
6、毫克级,克级,公斤级纯化、技术转让
7、提供完整的资料COA等相关检测数据满足申报要求
8、快速高效交付,品质高,售后服务质量好
成功案例对卡磺钠注射液多个杂质分离纯化,确定结构,帮助客户解决生产难题
桐晖药业,基于核磁、色谱及其联用技术,在分离纯化、结构确证细分领域潜心钻研十余载,现为您提供技术专属性强、纯度高、重现性好、结构确证无误的专业解决方案,助力药品研发。
关键字: 乌拉地尔杂质21;乌拉地尔杂质21杂质;乌拉地尔杂质21对照品;乌拉地尔杂质21杂质制备;乌拉地尔杂质21杂质;
广州市桐晖药业有限公司成立于1999年,国家GSP认证,主要经营中西药制剂及化学原料、医药化工原料和医药中间体等产品。桐晖拥有雄厚的经济实力,是一家集市场营销、学术推广、进出口、新产品研发、合作生产为一体的现代企业。
桐晖药业是行业中的进口药专家,积极快速引进国外战略性新产品,尤其是国内紧缺或空白的新产品,已与全球各大药企建立深入的合作关系,致力于将国际上最新、最好的产品引入中国市场,打造中国医药行业排头兵。
桐晖药业是世界新产品进出口的专业平台,在国际医药界享有很高的名望和美誉。它拥有一支专业的营销部、市场部和进口注册团队,具有专业的产品打造力,高度准确的终端占有力,打造同类产品中的优秀品