钛酸锂性质、用途与生产工艺
钛酸锂(Li4Ti5O12)是一种金属锂和低电位过渡金属钛的复合氧化物,具有缺陷的尖晶石结构。20世纪70年代被作为超导材料进行大量研究, 80年代末曾作为锂离子蓄电池的正极材料进行研究, 但因为它相对于锂电位偏低且比能量也较低(理论比容量为175 mAh/g), 而未能引起人们的广泛关注。1996年, 加拿大研究者K.Zaghib首次提出可采用钛酸锂材料作负极与高电压正极组成锂离子蓄电池、与碳电极组成不对称超级电容器。后来, 小柴信晴等人也将其作为锂离子负极材料开展了研究。但直至1999年前后, 人们才对Li4Ti5O12作为锂离子蓄电池的负极材料开始了大量的研究。
具有尖晶石结构的钛酸锂由于其在嵌脱锂过程中晶格常数几乎不发生变化,被称为“零应变”材料,其理论嵌锂电位为1.55V(vs.Li+/Li),理论比容量为175mAh/g,由以下优点:(1)在充放电过程中不会发生结构变化;(2)相对于Li+/Li的放电电压接近1.55 V,不与电解液发生反应且不易引起金属锂析出;(3)锂离子扩散系数(2×10-8cm2/s) 比碳负极高一个数量级;(4)库仑效率高、原料无毒、价廉,适合环保和大规模开发;(5) 化学稳定性好、制备简单等,作为锂离子动力电池负极材料,有望解决锂离子电池的快速充电性能和安全性能,具有良好发展和应用前景。
Li4Ti5O12具有尖晶石结构,空间群为Fd3m,其中O2-位于32e位置,构成FCC点阵,部分Li +位于四面体8a 间隙中,剩余Li +和Ti4 +位于八面体16d 间隙中,因此,其结构式为: [Li]8a[Li1/3Ti5/3]16d[O4]32e,晶格常数a =0.836nm。
当外来的Li+嵌入Li4Ti5O12的晶格时,这些Li +开始占据16c 位置,而原来四面体8a 位置的Li +也开始迁移到八面体16c 位置,最后所有的16c 位置都被Li + 占据,形成了岩盐型结构的[Li2]16c[Li1/3Ti5/3]16d[O4]32e,所以其容量主要受可容纳Li +的八面体空隙的数量所限制。显然,八面体16d 位置的Li +、Ti4 +和Li +的脱嵌没有关系,只是四面体8a 位置的Li +进入了八面体16c 位置,所以原尖晶石结构嵌入Li +后并未改变格子常数,电极电势不变,其充放电过程的相转变可以用方程式[Li]8a[Li1/3Ti5/3]16d[O4]32e + xe - + xLi + →[Li1 + x]16c[Li1/3Ti5/3]16d[O4]32e来表示。反应产物Li7Ti5O12为淡蓝色,由于出现Ti4 +和Ti3 +变价,其电子导电性较好,电导率约为10-2S/cm。
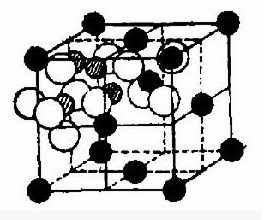
图1为钛酸锂的尖晶石型结构
有关钛酸锂的结构与性能、制备方法等是由Chemicalbook的东方编辑整理。(2016-01-13)
尖晶石型钛酸锂制备方法常见的主要有固相法、液相法及其它方法。固相法又可细分为高温固相法、微波加热法、固相快速冷却法等方法。液相法包括溶胶凝胶法、水热反应法、溶剂蒸发法及水解法等。此外,还出现了一些复合方法,如熔盐法辅助固相法、喷雾干燥法及微波法辅助溶胶凝胶法等方法。
1.固相法
固相法制备尖晶石型Li4Ti5O12具有明显的优点,即操作简单,对设备要求低,适用于大规模生产。但是缺点也很明显,如产物粒径不均匀,晶形不规则,合成周期长,化学计量控制难等。
目前Li4Ti5O12 的制备主要采用高温固相法。通常是由TiO2 与Li2CO3 或LiOH 等锂盐作为原料,反应温度通常在800℃~1000℃,反应时间多在10h~24h。高温固相法制备出的Li4Ti5O12 颗粒比较粗,粒径多为微米级。方兴[7]等人以Li2CO3 和纳米TiO2 为原料,在800℃时焙烧24h 制备出了粒径为0.2μm~0.4μm 的钛酸锂颗粒,其首次放电容量为167mA·h/g,经过80 次充放电循环后,容量变为162mA·h/g。郭志红等人在二步煅烧的基础上,系统研究了高能球磨时间对制备出的Li4Ti5Ol2 粒径及电化学性能的影响。前驱体球磨2 h 制得的Li4Ti5Ol2颗粒分布均匀,有良好的流动性,振实密度达1.70 g/cm3,0.1 C 首次放电比容量为174 mA·h/g, 接近理论比容量175 mA·h/g,5C 时放电比容量为124.2 mA·h/g。
微波加热法具有迅速、清洁、高效、低耗及产品纯度高等特点。LIJ等利用微波加热法制备出了纯相的尖晶石钛酸锂,在0.1mA/cm2 时首次放电容量达到162 mA·h/g, 在0.4mA/cm2 时首次放电容量达到144mA·h/g。
2.液相法
液相法具有化学均匀性好,化学纯度高,化学计量比可精确控制等优点。
溶胶-凝胶法多用钛酸四丁酯、醋酸锂或其它锂盐为原料,以乙醇为溶剂,按化学计量比制备成溶液,用月桂酸、乙酸、柠檬酸等作为螯合剂,焙烧温度通常在700~800℃。王瑾等以月桂酸为分散剂,无水乙醇为溶剂, 采用无水溶胶-凝胶法合成了高分散的Li4Ti5O12 纳米晶,粒径约为120~275nm,基本无团聚,具有较好的分散性。0.1C 首次充放电比容量分别为244.57 和229.1mAh/g, 首次充放电效率为93.7%。经过50 次循环后,放电比容量降为192. 7mAh/g,平均每次循环,仅有0.21%的容量衰减,具有较好的循环稳定性。高倍率下的放电性能良好, 在0.5、1、2 和5C 倍率下, 首次放电比容量分别为174.7、163.3、132.3 和100.3mAh/g,循环性能良好。
水热法制备的尖晶石钛酸锂产物粒径分布均匀,且粒径较小。Y.F. Tang等利用水热法合成了尖晶石Li4Ti5Ol2 纳米花样结构。在0.2C时最高容量高达167mA·h/g,100 次循环后在8C 时为152mA·h/g,表现出优秀的电化学性能。
3.其它方法
熔盐法以低温熔融盐为反应介质,有效地降低了反应温度,缩短反应时间。高利亭等人以低温共熔锂盐0.38 LiOH·H2O-0.62LiNO为锂源和熔盐, 锐钦矿TiO2 为钛源, 采用熔盐辅助固相法制备纳米Li4Ti5O12。经三段式锻烧工艺制得的Li4Ti5O12 具有优异的电化学性能,20C首次放电比容量可达到110.6 mAh/g, 循环1000次后容量保持率为89.8%。
目前主要是通过金属离子掺杂、碳包覆、碳和金属复合以及制备纳米颗粒来提高Li4Ti5O12电极材料的电导率和电化学性能。
1.金属离子掺杂Li4Ti5O12
金属离子掺杂一方面可降低Li4Ti5O12复合材料的嵌脱锂电位,另一方面可提高复合材料电导率。
2.碳包覆Li4Ti5O12
碳包覆Li4Ti5O12可以提高Li4Ti5O12材料的电子电导率,从而提高材料的电化学性能。
3.Li4Ti5O12与碳或金属复合
研究发现,制备Li4Ti5O12与碳或金属复合研究发现,制备Li4Ti5O12与碳或金属复合材料能有效提高Li4Ti5O12倍率性能。
4.减小Li4Ti5O12粒径
减小Li4Ti5O12粒径能缩短锂离子的扩散路径,使Li4Ti5O12的倍率性能明显提高;然而当Li4Ti5O12颗粒过小时,由于固溶效应使放电平台的缩短,较大反应活性面积导致不可逆容量增加,尤其当材料放电电位较低时,上述现象更明显。近来,人们制备由纳米级一次颗粒组成微米级二次颗粒的Li4Ti5O12,材料不但具有纳米级一次颗粒优越的倍率充放电性能,同时二次颗粒的比表面积明显降低,不可逆容量减小,振实密度增加,这种微米级二次颗粒Li4Ti5O12具有极大的应用价值。
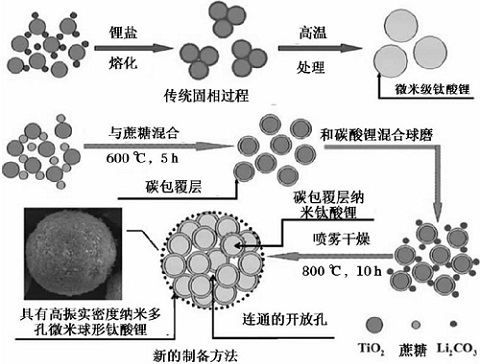
图2为微米级碳包覆Li4Ti5O12制备流程图
化学性质
钛酸锂为白色粉末,熔点1520~1564℃,不溶于水,有很强的助熔性质。
用途
用于含钛釉原料,用量少即具有助熔性质,可用做助熔剂。
生产方法
将等摩尔偏钛酸和氢氧化锂反应,经过滤、分离、干燥制得。
钛酸锂
上下游产品信息
上游原料
下游产品