RNA修饰,如N6-甲基腺苷(N6-methyladenosine,m6A),已被证明在生理或病理条件下调节多种细胞功能。5-甲基胞嘧啶(m5C)也被报道参与RNA代谢调控。特别是,m5C不仅在核糖体RNA和转移RNA中被检测到,而且在信使RNA中也通过基于高通量测序的转录组范围的作图方法被检测到。据报道,mRNA中的m5C修饰是由NOP2/Sun RNA甲基转移酶家族成员2 (NSUN2)催化的,在mRNA的翻译起始位点附近、3’UTRs和Argonaute结合区域附近有明显的富集。在病理条件下,特别是在人实体肿瘤中,对m5C等RNA修饰的分子动力学和/或功能仍缺乏详细的研究。
人类膀胱尿路上皮癌(UCB),包括两大类临床病理类型的非肌肉浸润性膀胱癌(NMIBC);pTa/1)和肌肉浸润性膀胱癌(MIBC,pT2–pT4),提供了一个理想的模型系统来研究肿瘤发生和/或肿瘤进展的多阶段特征。在这项研究中,我们提供了人类UCBs中mRNA m5C修饰的单核苷酸解析图,并揭示NSUN2和Y-box结合蛋白1(YBX1)作为m5C的特定“作者”和“读者”,分别通过靶向其3’UTR上的m5c修饰位点,稳定肝素结合生长因子(HDGF)的癌基因mRNA,从而在UCB中发挥重要的致癌作用。因此,我们的研究结果阐明了RNA m5c介导的癌基因激活在UCB发病机制中的调控机制,并为靶向UCB中的NSUN2/YBX1/m5C-HDGF信号轴提供了治疗理论依据。
研究结果
1.RNA m5C在UCB组织中的分布
为了在UCBs中绘制单碱基分辨率下的转录组m5C修饰图,我们对36个UCB和29个邻近正常组织(包括22对癌变和非癌变膀胱组织)进行了改进的RNA亚硫酸氢盐测序(RNA- BisSeq)方法。我们发现,大多数m5C位点(约为90%)存在于mRNA中,并且在在每个样本的2,281-8,957个mRNA中识别出7,204-115,867个m5C位点。
每个样品中m5C位点的甲基化中值在0.15 ~ 0.23之间。m5C位点在编码序列和3’UTRs中富集,有趣的是似乎在翻译起始位点下游的编码序列区域富集。序列频率logo显示了在GC丰富的区域中嵌入m5C位点的特征。这些发现与以前关于HeLa细胞和小鼠组织的报道一致5,8,这表明这些特征不仅在不同物种中高度保守,而且在人类正常组织和肿瘤组织中也高度保守。
2. m5C在UCBs中经常高甲基化,并在致癌途径中富集
我们的RNA-BisSeq数据显示,5280个m5C位点的甲基化水平在肿瘤和正常组织之间存在显著差异。其中,2041个mRNA中有4,126个m5C位点高甲基化,504个mRNA中有1,154个m5C位点在UCBs中相对于正常对照组显示低甲基化,表明m5C位点在UCBs中经常高甲基化。与此相一致的是,对5对配对肿瘤和邻近正常组织的超高效液相色谱-三重四极质谱联用多重反应监测(UHPLC-MRM-MS /MS)分析显示,肿瘤样本中整体mRNA m5C含量增加。
UCB中频繁发生的m5C高甲基化使我们明确了m5C高甲基化mRNA的功能。利用独创性途径分析(IPA)的功能富集分析表明,高甲基化mRNA主要富集于十个典型的癌症相关途径。基于IPA和之前报道的研究结果,这些通路中有6个(JAK-STAT、ERBB、PI3K-AKT、VEGF、上皮细胞向间质转化(EMT)和ERK-MAPK)中的103个基因在肿瘤中甲基化倾向增加。图1a显示了50个代表性基因的热图,其中12个基因在肿瘤中甲基化增加最多(每个途径1-3个)(图1b)。相比之下,m5c -低甲基化基因主要富集于线粒体功能和免疫应答相关通路。综上所述,m5C高甲基化在UCBs中是一个频繁的事件,高甲基化mRNA在致癌通路中富集。
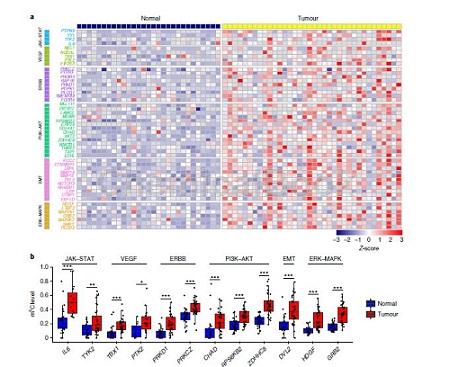
图1:UCBs中的RNA m5C高甲基化图
3. m5C高甲基化与UCBs中癌基因mRNA过表达有关
为了研究m5C修饰与基因表达的关系,我们对同一队列36个UCBs和29个邻近正常组织进行了RNA测序(RNA- seq),并在UCBs中识别出m5C位点高甲基化的差异表达mRNA(600个上调,244个下调)(图2a)。有趣的是,几个致癌基因,即HDGF、F11受体(F11R)、RAB11家族相互作用蛋白4 (RAB11FIP4)和MLLT11, 在UCBs中均表现出m5C高甲基化和mRNA上调(如图2b中的HDGF),并在检测的UCBs中表现出显著相关性(图2c)。这种强相关性在22对UCB和正常组织中得到进一步验证(图2d,e)。Kaplan-Meier对癌症基因组图谱(TCGA) UCB队列中这些癌基因的分析显示,它们的高表达水平与无病生存(DFS)降低之间存在正相关;图2f)。此外,在中山大学癌症中心(SYSUCC)的UCB队列中,上述致癌基因的m5C水平与NSUN2表达呈正相关。这些数据表明,m5C对mRNA的修饰可以增强与UCB进展相关的某些癌基因mRNA表达。
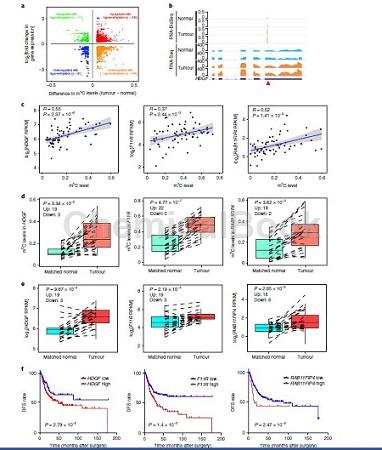
小结
基因组研究揭示了驱动UCB发病机制的关键基因突变,如大多数NMIBC31病例中的FGFR3激活,以及包括TSC1和CDH1在内的肿瘤抑制基因的频繁失活32,33。最近的一项研究发现,有58个基因——包括KMT2C、ATM和fat1——在MIBC中发生了显著的突变,总体突变负荷与APOBEC -signature突变有关。此外,包括异常DNA甲基化和组蛋白修饰在内的表观遗传机制也参与了UCB的发育14,34。RNA m6A修饰的失调通过调节癌基因表达在人类癌症中发挥着不同的作用。
在此,我们提供了人类UCB中单碱基分辨率RNA m5C的图谱,并证明RNA m5C高甲基化是UCB中致癌基因激活的另一个分子事件,这得到了以下证据的有力支持:
(1)m5C mRNA的高甲基化在癌症相关通路中高度富集,如PI3K-AKT35和ERK-MAPK36,与正常组织相比,许多癌基因,如HDGF,在UCB组织中经常发生m5C高甲基化,并且在肿瘤从NMIBC进展到MIBC过程中显著上调;
(2)m5C writer NSUN2和m5C reader YBX1在UCBs中异常升高,从而通过增强HDGF mRNA在m5C位点依赖机制中的稳定性,促进UCB的发病机制;
(3)除UCB外,其他类型的实体肿瘤HDGF与YBX1表达均有显著相关性。此外,在UCB和其他实体肿瘤中,NSUN2、YBX1和HDGF这三种蛋白的高表达预测了最低的存活率。
综上所述,这些结果表明RNA m5C高甲基化代表了包括UCB在内的人类肿瘤中癌基因激活的一种机制,并可能作为一种有价值的预后生物标志物来区分晚期和/或生存期较差的UCB患者。
