背景[1-3]
人半胱氨酸蛋白酶包括组织蛋白酶B、H、L等,一般存在于溶酶体,主要参与细胞吞噬和细胞内多余物质的清除和消化。半胱氨酸蛋白酶(Caspases)是半胱氨酸蛋白酶家族,是程序性细胞死亡或凋亡的关键介质,是活细胞通往死亡之路的引导者。所有半胱氨酸蛋白酶的前体形式由前结构域和大小催化亚基组成。半胱氨酸蛋白酶的活化由几种刺激产生,包括配体-受体相互作用、生长因子剥夺和细胞功能抑制剂。
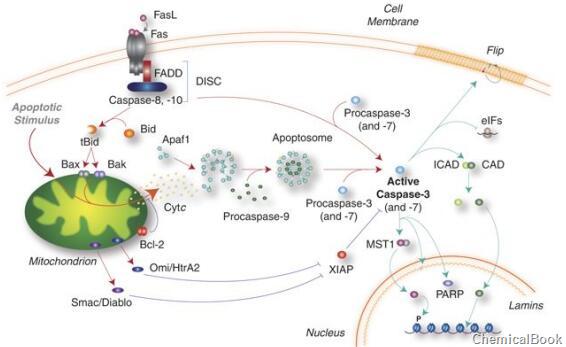
所有已知的半胱氨酸蛋白酶都需要在天冬氨酸附近裂解以释放一个大亚基和一个小亚基,这些亚单位结合成a2b2四聚体以形成活性酶。半胱天冬酶-3(Caspase-3)基因也称为Yama、CPP32和凋亡蛋白,编码32 kDa蛋白。Caspase-3最主要的底物是多聚(ADP-核糖)聚合酶PARP(poly(ADP-ribose)polymerase),该酶与DNA修复、基因完整性监护有关。在细胞凋亡启动时,Caspase-3被Asp-28/Ser-29(在N末端前结构域之间)和Asp-175/Ser-176(在大亚基和小亚基之间)的切割激活,产生17kDa的大亚基和12kDa的小亚基。p17和p12二聚化形成活化形式的cleaved caspase-3。
应用[4][5]
用于基质金属蛋白酶MT3-MMP的分离、纯化和包涵体复性研究
细胞外基质(ECM)是存在于细胞与细胞之间的动态网状结构,由胶原、蛋白多糖、糖蛋白、糖胺多糖和弹力纤维等五大类物质组成。细胞外基质广泛存在于机体各组织、器官中。细胞外基质不仅起细胞与细胞之间的机械支持和连接作用,也是细胞和细胞之间信号传递的桥梁。细胞外基质降解酶系至少有六大类:脯肽酶、丝氨酸蛋白酶、半胱氨酸蛋白酶、天冬酰胺蛋白酶、糖苷酶、基质金属蛋白酶(MMP)。其中基质金属蛋白酶是降解细胞外基质成分最重要的酶。因为:a.MMPs直接以酶原的形式分泌到ECM中,并在正常生理条件下发挥作用。b.MMPs的表达及活性均受到严格调控,且在ECM重组的部位易于诱导表达。c.MMPs中的一些酶是迄今为止已发现的唯一能分解纤维类胶原的酶。基质金属蛋白酶是由细胞分泌的Zn2+金属内肽酶的总称,参与许多基质成分的降解。迄今为止,发现的人MMP共有23种,根据其在细胞内的位置不同,可分为分泌型和膜结合型。分泌型MMP可分为胶原酶(MMP-1,-8和-13),胶原酶(MMP-2,-9),基质溶胞素(MMP-3,-12)和其他如MMP-7,-11,-18/-19等。膜结合型MMP包括①.II型跨膜半胱氨酸排列MMP-23,②.糖基化磷脂酰肌醇结合MMP-17和-25即模型MT-MMP4和MT-MMP6③.I型跨膜MMP14,-15,-16和-24/MT-MMP1,2,3和5。一些分泌型MMP如(pro)MMP-2被募集到细胞表面并在该处被活化,从而对病灶发生蛋白水解作用。膜结合型MMP在细胞膜上的定位使他们处于一个促进肿瘤侵袭的位置。在正常和病理情况下,MMP具有广泛的蛋白水解作用。MMP的正常生理功能包括神经生长,细胞迁移、骨头伸长,伤口愈合、血管发生、排卵、精子成熟、子宫萎缩、月经、牙釉质形成、抗原发生、乳腺生长、头发小囊的生长,胚胎生长。病理过程包括MMP参与肿瘤的生长和迁移、纤维化、关节炎、青光眼、狼疮、硬皮病、肝硬化、各种硬化症、动脉瘤、不育病和其他疾病。在肿瘤的发生和发展过程中,MMP常过度表达,降解基底膜和细胞外基质,导致肿瘤的侵袭转移及血管形成。因此,以MMP作为治疗靶点,设计并寻找针对MMP的拮抗药物,尤其是可选择抑制MMP的药物,是近年来肿瘤治疗的热点。
参考文献
[1]Urea gradient size-exclusion chromatography enhanced the yield of lysozyme refolding[J].Zhenyu Gu,Zhiguo Su,Jan-Christer Janson.Journal of Chromatography A.2001(2)
[2]Generation and degradation of human endostatin proteins by various proteinases[J].Mercedes Ferreras,Ute Felbor,Thomas Lenhard,Bjorn R.Olsen,Jean-Marie Delaissé.FEBS Letters.2000(3)
[3]Extracellular matrix remodelling and cellular differentiation[J].Charles Streuli.Current Opinion in Cell Biology.1999(5)
[4]Expression,purification and charaterization of recombinant mouse MT5-MMP protein products[J].Xing Wang,Jun Yi,Jianxun Lei,Duanqing Pei.FEBS Letters.1999(3)
[5]史秀娟.基质金属蛋白酶MT3-MMP的分离、纯化和包涵体复性研究[D].吉林大学,2004.
