【背景及概述】[1][2][3]
骨质疏松症是由多种原因引起的单位体积内骨组织量减少,导致骨脆性增加,直至发生骨折的代谢性骨病,骨折是骨质疏松症最严重的并发症,多发生于髋部、脊柱及桡骨远端。骨质疏松症使患者骨密度降低、骨小梁稀疏、骨皮质变薄、骨骼显微结构异常、微细损伤积累,导致骨质疏松性骨折具有高并发症发生率(19% ~ 25%)、高致残率(31.4%) 及高死亡率(20% ~ 25%) 的特点,给患者带来了极大的痛苦和经济负担。骨质疏松性骨折主要采取手术固定的治疗方法,但其没有从根本上解决骨折。内固定会加重骨折处的骨吸收,造成骨折延迟愈合,甚至不愈合。双膦酸盐类药物虽然是当前应用最广泛的抗骨质疏松药物,但骨折围术期应用双膦酸盐类药物可能会影响骨折愈合,具有潜在风险。
特立帕肽是PTH 的活性片段(PTH1-34,C181H291N55O51S2),分子量为4 117.8 U,是目前唯一可以促进骨合成代谢的药物。该药物由美国礼来公司通过生物合成技术,以大肠埃希菌为宿主研发的一种甲状旁腺素的衍生物。其34 个氨基酸序列与人体PTH 的N 端氨基酸序列一致,保持了PTH 完整的生物活性。与天然PTH 相比,保存了与PTH- I受体结合调节成骨细胞的作用,同时也消除了PTH的C 端所带来的促进骨凋亡作用。2002 年12 月美国FDA 批准其上市,用于绝经后女性和男性骨质疏松的治疗,推荐剂量为20μg/d。皮下注射本品20μg,达峰时间30 min,半衰期为60 min,3 h 内即可降至不可测水平。静脉注射血清半衰期为5 min,生物利用度为95%,90% 药物经肾清除。
【结构】

【适应症】[3]
美国FDA批准用于绝经后女性骨质疏松症以及高度骨折风险的男性骨质疏松症(包括性腺功能减退引起的继发性骨质疏松症)的治疗。
【规格】[4]
注射剂:20μg:80μl,2.4ml/支
【用法用量】[4]
推荐剂量为每日皮下注射20微克,注射部位应选择大腿或腹部。应指导患者使用正确的注射方法。患者也可参阅醋酸特立帕肽所附的使用手册来正确的使用注射笔。醋酸特立帕肽总共治疗的最长时间为24个月。病人终身仅可接受一次为期24个月的治疗。如果膳食不能满足需要,患者应当补充钙和维生素D。停止使用醋酸特立帕肽治疗后,患者可以继续其它骨质疏松治疗方法。
肾功能不全患者:醋酸特立帕肽不得用于严重肾功能不全患者。有中度肾功能不全患者应慎用醋酸特立帕肽。
肝功能不全患者:未在肝功能不全患者中进行研究,应在医生指导下慎用。
【药理作用及作用机制】 [2]
特立帕肽可通过抑制成骨细胞凋亡、激活骨衬细胞和增强成骨细胞分化来介导骨代谢。通过调节腺苷酸环化酶- 环磷酸腺苷- 蛋白激酶A 传导通路间歇性刺激成骨细胞、骨衬细胞和骨髓基质干细胞表面PHT- I受体,促进成骨细胞的分化、延长成骨细胞寿命;通过磷酸酯C- 胞浆钙离子-蛋白激酶C信号传导通路,刺激成骨细胞系增殖;通过抑制PPARγ 的反式激活活性,减少基质细胞向脂肪细胞系分化,使成骨细胞数量增加;通过调节细胞因子间接调节骨的成长,例如可以诱导iGF-1与成骨细胞结合,从而促进骨的形成;通过Wnt 信号通路调节骨形成的过程,从而增加骨的形成
【药代动力学】[2]
特立帕肽皮下注射后吸收及消除速度都很快,皮下注射本品20 μg, 达峰时间(tmax)为30 min, 半衰期(t1/2 )为60 min, 静脉注射血清半衰期为5 min,绝对生物利用度95%。90%药物经肾脏清除。目前进行的临床研究多以皮下注射为给药方式。对10 名健康受试者比较肺部给药1 600 IU与皮下注射400 IU在达峰时间与峰浓度的差异, 结果表明, 肺部给药达峰时间为(10 ±5)min, 快于皮下注射给药达峰时间(28 ±8)min;肺部给药峰浓度为(309 ±215)pmol/L , 高于皮下注射给药峰浓度(10245)pmol/L, 生物利用度为48%, 因此认为肺部给药是有效的, 也是有可能代替皮下给药的途径之一。Nastech制药公司研发的人甲状旁腺激素鼻喷剂PTH(1-34)目前已进入II期临床试验, 其生物利用度与皮下注射特立帕肽相似。
【不良反应】[3]
特立帕肽注射后常见不良反应包括头晕、背痛、恶心和下肢痉挛等, 多为一过性;少见的不良反应包括心律失常、耳聋等。目前认为不良反应发生与患者年龄和给药剂量之间无明显关系。在大鼠研究中发现特立帕肽使骨肿瘤如骨肉瘤发生率增加, 并且肿瘤发生与给药剂量与治疗持续时间相关。但美国FDA认为大鼠实验模型并不能真实代表人体研究的结果,药于2002年12月获FDA批准上市。在上市后进行的为期3年的前瞻性的临床研究, 并未发现使用特立帕肽使患者骨肿瘤发病率有所增加。但是目前仍建议在应用特立帕肽时, 具有骨肉瘤潜在危险性的对象如Paget骨病、骨骼放疗史的患者应避免应用。总结该药上市5年来相关安全性的报道以及自身应用的临床经验, 还发现特立帕肽可引起一过性血钙升高、高尿钙和高尿酸血症, 但发生率与安慰剂组比较无显著性差异。内源性PTH在特立帕肽每天1次20 μg皮下注射给药后立即出现了持续急剧下降, 考虑可能是特立帕肽抑制了甲状旁腺释放内源性PTH,并认为其氨基端也可能参与了这个负反馈。当停药6个月后内源性PTH水平较用药时上升。因此认为内源性PTH可作为特立帕肽用药监测的选择性指标。长期超生理剂量PTH对骨吸收作用大于骨形成, 因此寻找治疗骨质疏松症的剂量尤为重要。虽然多数临床研究均证明本品增加骨密度作用呈剂量依赖性增加,但是考虑安全性与不良反应的因素,目前临床常用的剂量为20 μg/d,并建议使用时间一般不超过2年。
【儿童用药】[4]
尚无醋酸特立帕肽在小于18岁的青少年中应用的经验。醋酸特立帕肽不得用于小于18岁的青少年和开放性骨骺的青年。
【老年用药】[4]
无需根据年龄调整剂量。
【合成】[5]
特立帕肽的合成方法主要有以下几种:
1)生物工程方法:该方法是原研厂商的制备工艺,先通过DNA重组和扩增技术,构建工程菌株及高效表达载体,然后通过发酵、分离提纯获得成品。与化学合成法相比,生物方法存在设备投入大、生产周期长、技术难点多、中间过程控制困难、分离纯化不便等缺点;
2)偶联方法:以王树脂为固相载体,从第34个氨基酸逐个偶联至第1个氨基酸[5]。该方法合成过程中,多个氨基酸的偶联比较困难,制备周期较长,收率偏低;
3)液相合成法:在液相里将每两个氨基酸合成一个二肽片段,再以该二肽片段为原料,固相合成整个34肽。该方法在一定程度上缩短了制备周期,但二肽的合成过程较繁琐,中控困难;
4)前体法:17-位氨基酸使用Boc-Ser(tBu)-OH偶联,得到特立帕肽前体,再经NH4I和二甲硫醚将16-和17-位氨基酸之间的酯键转化为酰胺键。该方法生产周期较长,氨基酸偶联效率较低,且酯键与酰胺键的转换需在液相中进行,不利于工业化生产;
5)改进前体法:在方法4)的基础上,使用Fmoc-Asn(Trt)-Ser(ψMe,Me Pro)-OH代替16,17位氨基酸进行偶联。由于假脯氨酸二肽结构的存在,破坏了β结构的稳定性,可一定程度上降低氨基酸的偶联难度。但Fmoc-Asn(Trt)-Ser(ψMe,Me Pro)-OH的价格较贵,购买不便,且反应难以完全,也不适用于工业化生产。
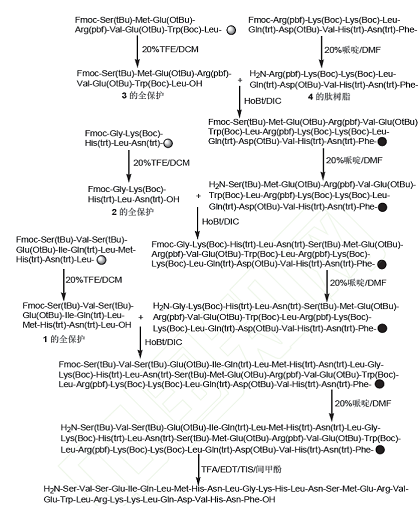
6)片段法:将特立帕肽序列中的34个氨基酸分成4个片段:1-11、 12-16、 17-24和25-34;以Wang Resin(王树脂)为固相载体制得25-34肽树脂;以CTC Resin(2-氯三苯甲基氯树脂)为固相载体制得1-11、 12-16和17-24等3个片段的全保护肽,然后将3个片段的全保护肽按照肽序依次缩合到25-34的肽树脂上,经三氟乙酸切割并脱除侧链保护基得特立帕肽粗品,再经液相色谱纯化特立帕肽,纯度大于99%,总收率达33%,其结构经MS(ESI)确证。
【主要参考资料】
[1] 张颖, 彭永德. 骨质疏松症治疗新药特立帕肽[J]. 世界临床药物, 2004, 25(12): 725-729.
[2] 娄盛涵, 张里程, 唐佩福. 特立帕肽治疗骨质疏松性骨折的研究进展[J]. 解放军医学院学报, 2016, 37(5): 522-524.
[3] 宋庆明, 盛正妍, 刘皋林. 特立帕肽治疗骨质疏松症的应用进展[J]. 国际药学研究杂志, 2008, 35(6): 415-418.
[4] 特立帕肽注射液说明书.
[5] 周建华, 陆丹, 朱永明.片段法合成抗骨质疏松多肽药物特立帕肽.2018
