背景及概述[1-2]
来源于S-腺苷蛋氨酸(S-adenosylmethioine,AdoMet)的甲基在特异的转甲基酶作用下可转移到各种受体分子(如:蛋白、核酸和小分子)上,S-腺苷高半胱氨酸(S-adenosylhomocysteine,AdoHcy)是所有AdoMet依赖的转甲基反应的产物,而S-腺苷高半胱氨酸水解酶(EC3.3.1.1)对AdoMet依赖的转甲基反应起着重要的调节作用。目前所知,在真核生物中S-腺苷高半胱氨酸水解酶催化S-腺苷高半胱氨酸水解生成腺苷(adenosine,Ado)和高半胱氨酸(homocysteine,Hcy)是S-腺苷高半胱氨酸代谢的唯一途径。S-腺苷高半胱氨酸作为AdoMet依赖的转甲基反应的竞争性抑制剂,当S-腺苷高半胱氨酸水解酶受到抑制时,将导致细胞内S-腺苷高半胱氨酸的积累,引起S-腺苷高半胱氨酸与AdoMet浓度比升高,进而抑制AdoMet依赖的转甲基反应,最终由于细胞内S-腺苷高半胱氨酸水平失控而产生细胞毒性。
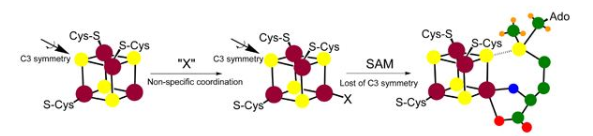
催化机制[1]
不同来源的S-腺苷高半胱氨酸水解酶均为低聚蛋白质,其每个亚基的分子质量为45000~50000,均含有一分子紧密结合的辅酶Ⅰ———烟酰胺腺嘌呤二核苷酸(E-NAD+)。S-腺苷高半胱氨酸水解酶催化S-腺苷高半胱氨酸水解为Ado和Hcy,其反应是可逆的,体外趋向合成,体内趋向水解。在体内,Ado可被Ado脱氨酶和Ado激酶消除,Hcy则用于合成半胱氨酸和生成蛋氨酸。在哺乳动物体内,Hcy只由S-腺苷高半胱氨酸产生。1979年,Palmer和Abeles提出了S-腺苷高半胱氨酸水解酶催化S-腺苷高半胱氨酸可逆水解的机制,即认为S-腺苷高半胱氨酸和Ado先被E-NAD+氧化,生成3′-酮衍生物,以便于酶的碱基(E-B2)吸引4′位的质子,产生负碳离子,然后消除5′位的取代基(Hcy或水)生成3′-酮-4′,5′-脱氢腺苷中间体,而Hcy或水又可与该中间体发生Michael加成反应,NADH还原3或4,生成终产物S-腺苷高半胱氨酸或Ado。
立体结构解析表明,S-腺苷高半胱氨酸水解酶的每个亚基含有3个结构域:催化域、NAD+结合域和C末端域,催化域和NAD+结合域折叠成椭圆体,C末端域远离亚基主体,延伸到与其相对的亚基中。酶在与底物结合或未结合时,其亚基的结构相同,但分子构象不同:未结合底物时为“敞开式构象”(openconformation),催化域和NAD+结合域之间有一个大裂缝;结合底物时形成“闭合式构象”(closeconformation),催化域和NAD+结合域之间的裂缝闭合。根据鼠的野生型S-腺苷高半胱氨酸水解酶及其D244E突变酶与3′-酮腺苷复合物(D244E·Ado*)的晶体结构,进一步阐明了S-腺苷高半胱氨酸水解酶的催化机制,确定其氨基酸残基Asp-130、Lys-185、Asp-189和Asn-190参与了催化反应:当酶未结合底物时主要采取“敞开式构象”,一旦底物进入活性位点,与Lys-185上ε-NH3+以氢键结合的Asp-189离去,并带走Lys-185的一个质子,催化域绕着分子的铰合部(hingesection)旋转17°,关闭它与NAD+结合域之间的大裂缝,以便使底物更靠近E-NAD+,中性的Lys-185与ENAD+分别从底物上3′-OH和3′-CH夺取质子,接着Asp-130再夺取底物上4′-CH质子,产生的负碳离子释放出H2O或Hcy,生成3′-酮-4′,5′-脱氢腺苷中间体。
S-腺苷高半胱氨酸水解酶抑制剂的开发[1]
1977年Chiang等首次论证了S-腺苷高半胱氨酸水解酶作为药物作用靶点的重要性,并测试了50多个Ado和S-腺苷高半胱氨酸的类似物作为S-腺苷高半胱氨酸水解酶抑制剂的功效,发现3-脱氮腺苷(c3Ado)是较强的S-腺苷高半胱氨酸水解酶抑制剂,随后,又发现2-氯腺苷、8-氨基腺苷、9-β-D-阿拉伯呋喃糖腺苷(Ara-A)及(±)aristeromycin等具有S-腺苷高半胱氨酸水解酶抑制活性。其中,(±)aristeromycin为碳环腺苷(C-Ado)类似物,它的发现推动了S-腺苷高半胱氨酸水解酶抑制剂的进一步化学修饰及其构效关系研究的开展。对腺苷的结构改造,包括碱基、糖基以及糖苷键构型的改造等等,其中以糖基的改造为主。
参考文献
[1]纪宇,李振涛,朱奇,李爱秀.S-腺苷高半胱氨酸水解酶及其抑制剂的研究近况[J].药学进展,2005(11):5-10.
[2]张丹亭. S-腺苷高半胱氨酸水解酶抑制剂在肝脏葡萄糖糖代谢中的作用[D].东北师范大学,2019.
