五水硫酸铜俗称蓝矾、胆矾或铜矾,为不规则的块状结晶体,深蓝或浅蓝色,半透明,似玻璃光泽。以块大、深蓝色、透明、无杂质者为佳。人和动物误食这种蓝帆晶体后会中毒,严重的会致命。但万事都有两面性,也是由于有毒性,它也是除草剂和农药中常见的成分。

制备五水硫酸铜实验原理:
铜是不活泼金属,不能直接和稀硫酸发生反应制备硫酸铜,必须加入氧化剂。在浓硝酸和稀硫酸的混合液中,浓硝酸将铜氧化成Cu2+,Cu2+与SO42-结合得到硫酸铜 :
Cu + 2HNO3 + H2SO4 == CuSO4 + 2NO2 + 2H2O
未反应的铜屑(不溶性杂质)用倾滗法除去。利用硝酸铜的溶解度在0~100℃范围内均大于硫酸铜溶解度的性质,溶液经蒸发浓缩析出硫酸铜,经过滤与可溶性杂质硝酸铜分离,得到产品。
了解原理啦,就让我们赶快看看到底是怎么做的吧~
实验步骤:
1.称量2.3g铜屑,(或氧化铜粉2.9克),将它置于干燥的蒸发皿中,灼烧至表面呈现黑色的氧化铜为止(目的在于除去付着在铜屑上的油污),冷却备用;
2.往盛有铜粉的蒸发皿中加入8.0mL3mol·L-1硫酸,然后缓慢加入3.5mL浓硝酸(反应过程中产生大量有毒的二氧化氮气体,操作时应注意通风)。待反应平稳后,盖上表面皿放在水浴上加热,加热过程中补加4.0mL3mol·L-1硫酸,1.0mL浓硝酸;

加入硫酸 补加浓硫酸
3.待铜粉全部溶解后,趁热用倾析法将溶液转至一个小烧杯中,留下不溶性杂质,然后再将硫酸铜溶液转回到洗净的蒸发皿中;
4.水浴缓慢加热蒸发皿,蒸发浓缩至结晶膜出现为止;
5.取下蒸发皿,使溶液冷却析出蓝色的五水合硫酸铜晶体;
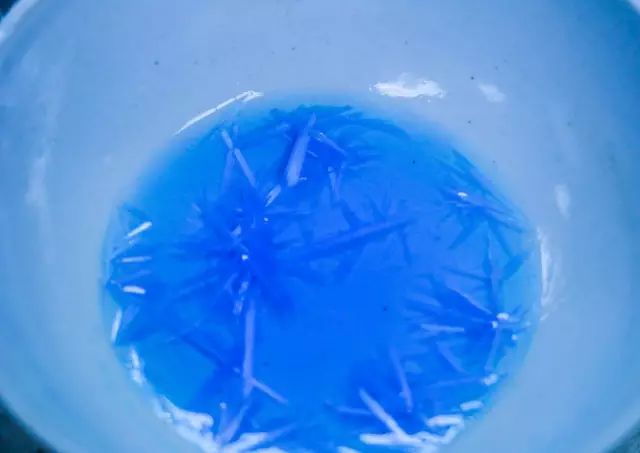
6.最后称重,完成~
