苯胺俗称“阿尼林油”。一种最重要的芳香胺。化学式C6H5NH2。 分子量93.13。无色油状可燃液体。比重1.022(20/20℃)。沸点184~186℃。折光率1.5863。露于空气中逐渐氧化成褐色。有特殊气味。有毒! 微溶于水,易溶于醇、醚中。呈碱性,与盐酸、硫酸、硝酸等作用成盐。化学性质活泼,易起氧化、重氮化(NaNO2/HCl)、烷基化以及酰化(醋酸、醋酐、酰卤)等取代反应。
化学性质
无色油状液体,有焦味。熔点-6. 3℃,沸点184.13℃、68.3℃(1.333kPa),相 对 密 度1.02173,折光率1.5863,在乙醇中UVλmax234.5、284.5nm。1g溶于28.6ml水、15.7ml热水,与乙醇、乙醚、苯、氯仿等有机溶剂混溶。水蒸气中挥发。毒性LD50500mg/kg(狗口服)。呈碱性,pKb=9.30,0.2mol水溶液pH8.1。与酸成铵盐,可与碱金属或碱土金属成盐,氨基存在使它作为亲核试剂能进行很多亲核反应,同时致活了芳环上的亲电取代。
化学反应
苯胺是弱碱,与稀盐酸反应生成盐。苯胺分子中的氯基为强的邻对位定位基,由于氨基的影响,使苯基上电子云密度增大,尤其邻对位电子密度较高,容易发生亲电取代反应。稀的苯胺水溶液与溴水立即反应,得到2,4,6-三溴苯胺白色沉淀。
在过量强酸溶液中,苯胺与亚硝酸发生重氮化反应(参见“重氮盐”)。苯胺容易被氧化成苯醌及一系列复杂产物。苯胺在空气中放置,逐渐被氧化变为红褐色。用K2Cr2O7酸性溶液氧化苯胺得到黑色物质。硝基苯还原可制得苯胺,还原剂可用Fe+HCl,Fe+H2O或催化氢化。苯胺是医药工业和染料工业的重要原料。
用途
苯胺是染料工业的重要原料。曾对发展人造染料工业起了重要作用。1856年年仅18岁 的英国化学家潘琴从煤焦油里提炼出苯胺,加 进重铬酸钾,偶然发现有黑色沉淀物,这就是第 一个人造染料,当时叫做阿尼林紫,因为它在酒 精中呈紫色。这是一种理想染料,耐洗、耐晒、 耐用而又色彩绚丽。潘琴获得英国专利后开办 了家人造染料厂,首先出售人造染料。在 此前煤焦油是一种废物,潘琴的发明使煤焦油 变废为宝。靛蓝原是一种蓝色天然植物染料, 由靛蓝植物加工制得。1870年德国化学家拜 耳首先完成靛蓝的工业生产,也是以苯胺为主 要原料与一氯醋酸共热,再经碱熔氧化等反应 而制得。苯胺还用于制取在羊毛、丝绸、棉织物 上染紫红色的碱性品红染料等。它还用于制取 氧化染料苯胺黑。后者又叫阿尼林黑,或精元, 其特点是耐洗、耐晒。将毛皮、棉织物等浸于苯 胺盐酸盐中,用氯酸钠等氧化剂氧化,织物表面 即生成苯胺黑。氧化过度呈蓝黑色,且易脆,氧 化不足则泛绿。苯胺又是磺胺药物的基本原 料,由苯胺先经磺化制成对氨基苯磺酸,再由它 衍生而制成各类磺胺药物。苯胺还是一些合成 树脂的重要原料,还用作橡胶硫化促进剂等。
合成方法
目前,以硝基苯、氯苯及苯酚为原料的苯胺的制造工艺已工业化。
以硝基苯为原料,用铁粉、盐酸还原的方法,是古老的方法,但由于可从副产的氧化铁泥浆中得到高价的氧化铁颜料,故至今仍在使用。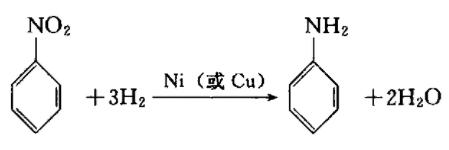
然而随着苯胺需求的增长,其制法改为硝基苯的气相氢气还原法。例如以镍或铜为基础的催化剂的固定床方式,在300~475℃ 加氢。
上述经过硝基苯的生产工艺,在硝化工序产生的废酸需处理,因而有环境污染问题, 故正在研究其他方法。近年来,日本采用将氯苯或苯酚进行氨解的方法。
氯苯在氯化亚铜、氯化铵存在下,与氨水在180~220℃加压反应,以91%的转化率变为苯胺。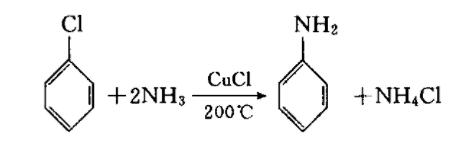
在催化剂存在下,可将苯酚进行气相氨解。以二氧化硅·氧化铝等为催化剂,在 425℃和20MPa(200kgf/cm2)加压下进行反应。苯胺转化率达90%,副产二苯胺和咔唑。
危险性
苯胺有毒,而且毒性很强,易经皮肤吸收,以及经呼吸道吸入而引起中毒。液态吸收率为:每平 方厘米皮肤每小时吸收苯胺0.2mg,随 气温升高,其吸收量还将增加,中毒时有 头晕、乏力、嘴唇发黑、指甲发黑、呕吐等 症状,饮酒后更容易引起中毒,如事先服 用牛奶则有解毒作用。在车间空气中的 最高容许浓度为5ppm。大鼠口服致死中 量为440mg/kg。本品遇明火、强氧化剂、 高温有火灾危险。相对密度:1.02 (20℃),凝固点:-6.2℃;沸点:184. 4℃;闪点:70℃;自燃点:615℃;爆炸极 限:下限为1.3%。贮存于阴凉通风处, 搬运时轻拿轻放,操作时用防护用具,污 染处用水冲洗,消防方法用水、泡沫、二 氧化碳和砂土。中毒急救时禁用醇类制 剂。工业上多用硝基苯在铁和盐酸或含 有铁和少量氯化亚铁的水溶液中进行还 原制得。本品是合成苯胺染料、磺胺药 物、苯胺甲醛树脂等的中间体,也是橡胶硫化的促进剂和火箭燃料。联合国编号 (UN No.)1547/6068/6.1-02/335,国内品名编号:61746,属有机有毒品。
