背景及概述[1][2]
阿巴瑞克由美国Praecis Pharma-ceuticals公司研制,2004年1月首次在美国上 市,阿巴瑞克抗肿瘤药,是目前得到批准的第1种可存储的促性腺激素释放激素拮抗剂配方,也是第1个新类型前列腺癌药。Amen与Praeeis公司认为该品主要通过降低睾酮水平而发挥作用并能提高疗效。另一种剂量的Abalelix,abarelix depot,正在子宫内膜增生患者中进行研究。
由于本品有潜在的严重不良反应,本品获准用于不适宜接受促黄体生成素释放激素(LHRH)激动剂治疗又拒绝手术切除、并有下述一种或几种情况的晚期症状性前列腺癌(PCA)的姑息治疗。阿巴瑞克主链氨基酸有10个,组成如下:Ac-D-Nal1-D-Cpa2-D-Pal3-Ser4-N-Me-Tyr5-D-Asn6-Leu7-Lys(iPr)8-Pro9-D- Ala10-NH2。阿巴瑞克通过直接抑制黄体生成素(LH)和促卵泡激素(FSH)分泌而减少睾丸内睾 酮的生成。由于直接抑制LH的分泌,因此血浆睾酮浓度不会先升高后降低的现象。饱和结合 研究结果显示,阿巴瑞克对大鼠垂体LHRH受体的亲和力很高。
结构
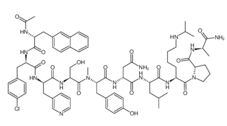
适应症[3]
本品获准用于不适宜接受促黄体生成素释放激素(LHRH)激动剂治疗又拒绝手术切除、并有下述一种或几种情况的晚期症状性前列腺癌(PCA)的姑息治疗:①由于肿瘤转移可能出现神经危害;② 由于局部侵犯或转移性疾病出现输尿管或膀胱出El阻塞;④ 由于肿瘤骨转移而出现严重骨痛需依赖麻醉性镇痛药。
规格[3]
注射用无菌粉末,每瓶含本品CMC 复合物113mg,临用前加入0.9%氯化钠溶液2.2mL溶解,使成2mL含本品l 00mg(50mg/mL)的一次给药剂量。每个单包装还包括一支稀释用的0.9%氯化钠注射液10mL、一支3cc带18号1 /2英寸注射针头的注射器和一个安全包装的Safety Glide22号1 /2英寸注射针头。
用法用量[3]
出于安全考虑,本品获准时带有市场限制。只有具有一定资格并表明承担相关义务、并在此基础上加入Praecis Pharmaceuticals公司Plenaxis PLUSProgram 的医生才有权开具本品的处方。推荐的用药方案为第1、15和29天给予本品100mg肌肉注射,每4周为一疗程式。在第29天注射前测定血浆睾酮浓度以确定治疗效果,其后每8周测定1次。
药理作用[4]
本品通过直接抑制黄体生成素(LH)和促卵泡激素(FSH)分泌而减少睾丸内睾酮的生成。由于本品直接抑制LH的分泌,因此血浆睾酮浓度不会有先升高后降低的现象。
药代动力学[3]
吸收:肌肉注射本品l00mg后,吸收缓慢,平均达峰时间为3天,血浆峰浓度为43.4ng/mL。
分布:消除终末期的表观分布容积为4040±1607L,提示本品在体内广泛分布。
代谢:肝细胞体外试验(大鼠、猴子、人)和体内试验(大鼠、猴子)显示,本品主要代谢方式是通过肽键水解。无论体内还是体外试验均未发现显著的氧化或结合代谢方式。尚无证据表明细胞色素P45参与了本品的代谢过程。
消除:人肌肉注射1 g/kg本品后约有13%以原型随尿液排出,尿液中未检出其他代谢产物。注射l00mg 本品后的肾清除率为14.4L/天(或10mL/min)。
不良反应[3]
1. 急性全身性过敏反应
在针对晚期症状性前列腺癌患者的临床研究中,81例患者中有3例在给药后数分钟内出现了急性全身性过敏反应。这些过敏反应有荨麻疹(第15天)、麻疹和瘙瘁(第29天)及低血压和昏厥(第141天)。患者注射本品后应至少观察3O分钟。在出现低血压和昏厥的情况下,应采取适当的救助措施,如抬高腿部、给氧、静脉输液、给予抗组胺药物、糖质激素和肾上腺素等。
在所有进行的本品用于前列腺癌的临床研究中(大部分为晚期无症状性前列腺癌),急性全身性过敏反应(在给药后30分钟内发生)的发生率为1.1%(15例/1397例)。在发生过敏反应的15例患者中有14例在注射后8分钟内就出现症状。这类反应的累积风险随着治疗时间的延长而增加。在第56、141、365和676天的累积发生率分别为0.51%、0.80%、1.24%和2.91%。发生低血压和昏厥哟患者有7例,发生率为0.5%。这类过敏反应在第56、141、365和676天的累积发生率分别为0.22%、0.32%、0.61%和1.67%。
2. 实验室指标变化
在小部分患者中观察到具有临床意义的血浆转氨酶升高。血浆转氨酶超过正常范围上限的2.5倍或>~200U/L的发生率分别为3.1%和0.8%。血红蛋白轻微下降为化学去势后的生理反应。在治疗组还观察到血浆甘油三酯水平出现平均10%的上升。
注意事项[3]
1. 在体重超过225磅的患者中,本品总体疗效下降、治疗持续时间延长程度较大。这部分患者应确保严格的血浆睾酮监测。
2. 在部分接受本品或类似药物的患者中观察到具有临床意义的转氨酶升高。
3. 在开始应用本品治疗前应测定血浆转氨酶水平并在治疗期间定期监测。
4. GnRH抑制剂和LHRH抑制剂可能导致骨密度下降。
药物相互作用[3]
有关本品的药物相互作用研究尚未正式进行。本品的代谢是否涉及细胞色素P450尚不可知。本品的血浆蛋白结合率较高(96%-99%)。
制备 [2]
一种合成阿巴瑞克的方法,包括以下步骤:
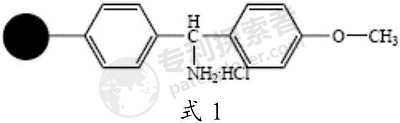
步骤1、保护的D-Ala在缩合试剂和活化试剂作用下和式1所示氨基树脂的氨基进行偶联反应,得到肽树脂1;
步骤2、按照阿巴瑞克氨基酸序列C端到N端的顺序,从肽树脂1出发,在缩合试剂和活化试剂作用下,将保护的Pro、保护的Lys(ipr,Z)、保护的Leu、保护的D-Asn、保护的N-Me- Tyr、保护的Ser、保护的D-Pal、保护的D-Cpa、Ac-D-Nal依次进行逐一延伸偶联,得到阿巴瑞克肽树脂;
步骤3、阿巴瑞克肽树脂经酸解剂酸解后得阿巴瑞克粗品;
步骤4、阿巴瑞克粗品纯化转盐后得阿巴瑞克纯品;
主要参考资料
[1] 阿巴瑞克. 中国药科大学学报 2005年第5期 439,共1页
[2] 马中刚;郭德文;曾德志;文永均.一种合成阿巴瑞克的方法. CN201610728619.3,申请日20160825
[3] 前列腺癌治疗药阿巴瑞克(abarel ix) .2007.I1.15 ,Vlo1.7 No.6
[4] 赖树清. 前列腺癌治疗药 阿巴瑞克 (abarelix)[J]. 世界临床药物, 2006, 5: 019.
