背景及概述[1][2]
慢性丙型肝炎是临床上常见的慢性严重传染性疾病,随着病情的进展逐渐发展为肝硬化、肝癌。据流行病学数据显示,中国估计约有1000 万的丙型肝炎患者。相较于乙型肝炎,丙型肝炎的公众知晓情况并不理想。世界肝炎联盟发起的肝炎患者全球调查数据显示,中国公众对丙型肝炎的认知度仅为25%,自主筛查率为19.4%。
此外,我国丙型肝炎诊断率仅为2%,且大多数的慢性丙型肝炎患者确诊时,已处于疾病晚期,并常发展为肝硬化和肝癌。丙型肝炎病毒(HCV)有较强的隐匿性,可在人体内潜伏10~20 年,且无明显症状。目前尚未有针对丙型肝炎的疫苗。此外,由于HCV 主要是通过血液传播,因此预防感染丙型肝炎应避免各类感染丙型肝炎的传播途径,如经输血和血制品传播、母婴传播等。
探究应对丙型肝炎的新型治疗方案一直未停止,丙型肝炎的治疗终点指标是持续病毒学应答率(SVR),传统的干扰素治疗周期长且易发生不良反应,从而降低患者的依从性。目前,随着直接抗病毒药物在欧美国家的上市,丙型肝炎治疗发生了巨大的变革,大幅提高了SVR。西咪匹韦(Simeprevir)和阿那匹韦(Asunaprevir)是第2代NS3/4A蛋白酶抑制剂,主要用于治疗基因1、4型HCV感染,疗效优于第1代,且不良反应较少。
阿那匹韦由百时美施贵宝研发,于2014年7月4日获日本药品医疗器械综合机构(PMDA)批准上市,商品名为Sunvepra。Sunvepra为口服胶囊,每粒含有100 mg阿那匹韦,推荐剂量为每次100 mg,每日2次,与达卡他韦(Daclatasvir)联合使用,24周为1个疗程。
结构
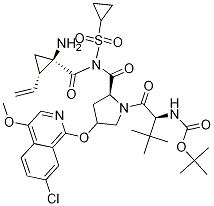
规格[3]
片:100毫克
用法用量[4]
通常情况下,口服给药一次,成人每天60毫克1次为Dakuratasubiru。这种药物用于与Asunapurebiru,给药期到24周联合。
应用[4]
2014年7月7日,日本卫生劳动福利部已经批准该公司出品daclatasvir(Daklinza)+asunaprevir(Sunvepra)联合用药,用于治疗丙型肝炎病毒(HCV)基因1型感染者,其中还包括治疗那些出现代偿性肝硬化的患者。美国食品和药物管理局(FDA)于2014年2月审批通过daclatasvir+asunaprevir组合方案,并将该方案认定作为突破性治疗方法,指定用于治疗HCV基因1b型感染。
在日本,daclatasvir+asunaprevir组合用药方案适用人群为慢性HCV基因1型感染合并或不合并代偿性肝硬化患者,这些患者不能耐受或不适用干扰素为基础的治疗方案,抑或对含干扰素治疗方案无应答反应;该用药组合旨在改善这部分人群的病毒血症情况。
药理作用及临床研究 [1][2]
Asunaprevir是丙肝病毒NS3/NS4A蛋白酶抑制剂,抑制NS3/NS4A蛋白酶对丙肝病毒翻译出来的多聚蛋白前体的水解,从而阻断病毒生命周期。Asunaprevir IC50值为1 nM。Asunaprevir是丙型肝炎病毒(HCV)NS3蛋白酶的抑制剂。它可以抑制丙型肝炎病毒的NS3 / 4A蛋白酶的6种主要基因型1a、1b、2a、2b、3a、4a、5a和6a,其 IC50值分别为0.7 nM、0.3 nM、15 nM、78 nM、320 nM、1.6 nM、1.7 nM和0.9 nM。
使用纯化的重组全长HCV NS3 / 4A蛋白酶复合物,对于基因型1a和基因型1b,asunaprevir的Ki值分别为0.4 nM和0.2 nM。其抑制的机理是asunaprevir的酰基磺酰胺与NS3蛋白酶的催化位点以非共价方式相互作用。在不同的细胞系,包括肝、T淋巴细胞、肺癌、子宫颈癌和胚胎,asunaprevir抑制HCV RNA复制。Asunaprevir对于其它RNA病毒无明显作用。Asunaprevir的渗透性类似于在人体内可以良好吸收的化合物。
Asunaprevir的代谢率测试表现出低的中间代谢清除。在体血浆和组织暴露显示,asunaprevir具有一定的嗜肝性。日本HCV基因1型感染者接受daclatasvir+asunaprevir方案治疗,有84.7%的患者在治疗结束后24周达到持续病毒学应答(SVR24)。65岁以上不能耐受或不适用干扰素方案的丙肝患者中,有91.9%的患者接受该方案治疗后达到SVR24;基线时出现代偿性肝硬化的患者中,总体达到SVR24比例为90.9%。研究对象中仅有5%患者因为不良反应而中断治疗。
III期试验:该项研究为开放标签、平行组III期研究,在干扰素不适用/不耐受(IN/I,n=135)和干扰素/利巴韦林治疗无应答(NR,n=87)的慢性丙型肝炎(HCV)基因型1b日本患者中开展,研究中,患者接受为期24周全口服、无干扰素、无利巴韦林的DCV+ASV(60mg DSV +100mg ASV,每天2次)方案治疗后,87.4%的患者实现了持续病毒学应答率(SVR24:治疗结束至随访24周时以灵敏的PCR方法检测血清HCV RNA为阴性,即实现“病毒学治愈”,这是最重要的治疗目标),其中IN/I患者群体SVR24为87.4%,NR群体SVR24为80.5%。此外,年龄大于65岁的患者群体中,IN/I患者群体SVR24为91.9%,NR群体SVR24为85.2%。
不良反应
严重不良反应事件发生率较低(5.9%),几乎没有严重不良反应发生超过1例患者。总体来看,鼻咽炎是最常见的不良反应(30.2%)。
主要参考资料
[1] 盐酸达拉他韦联合阿舒瑞韦治疗慢性丙型肝炎的经济学评价
[2] 百时美施贵宝公司正在进行BMS-650032的Ⅱ期临床开发
