背景[1-3]
人原代肝细胞源自单一健康供体,具有高细胞活力并可持续培养5天以上,适用于疾病建模、基因组学应用以及其他需要高质量贴壁肝细胞的研究,但不适合药物相互作用研究。
肝脏表面有一薄层致密的结缔组织构成的被膜。被膜深入肝内形成网状支架,将肝实质分隔为许多具有相似形态和相同功能的基本单位,称为肝小叶。人类肝脏约有50万个肝小叶。肝小叶呈多角棱柱体,约l毫米×2毫米大小,小叶的中轴贯穿一条静脉,为中央静脉。
肝细胞以中央静脉为中心呈放射状排列,形成肝细胞索。肝细胞索相互吻合成网,网眼间有窦状隙和血窦。肝细胞间的管状间隙形成毛细胆管。因此可以说,肝小叶是由肝细胞、毛细胆管、血窦和相当于毛细淋巴管的窦周隙(狄氏间隙)所组成。
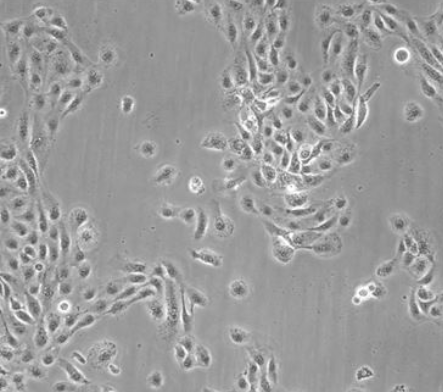
人原代肝细胞
肝细胞为多角形,直径约为20微米~30微米。肝细胞核呈圆形,位于细胞的中央,其内有1个或多个核仁。电子显微镜下细胞浆内可显示各种细胞器和包含物,如线粒体、高尔基体、溶酶体、内质网、糖原、脂滴和色素等。细胞核内有染色质,由螺旋结构的脱氧核糖核酸(DNA)和蛋白质组成。
应用[4][5]
用于人原代肝细胞的分离、培养及可逆性永生化研究
建立大动物肝组织灌流分离原代肝细胞的方法;建立用携带永生化基因的逆转录病毒感染原代肝细胞实现肝细胞可逆性永生化的方法。
方法:采用改良的四步循环灌流法分离乳猪肝细胞,然后用SSR#69包装细胞释放的携带Cre/LoxP系统/SV40T及潮霉素抗性基因的逆转录病毒感染猪原代肝细胞,潮霉素筛选阳性克隆细胞团,克隆环挑选目的克隆增生细胞团进行单独传代培养。最后添加Cre重组酶,切除两个LoxP位点间的永生化基因SV40T,实现永生化的逆转。
结果:共获得6块大小合适的猪肝组织,成功分离获得活性很高的大量原代猪肝细胞(产量:9.4±7.5×106/g肝组织;活性:94.6±4.2%)。在此基础上利用SSR#69释放的含有SV40T的逆转录病毒转染猪肝细胞获得成功,永生化的肝细胞具有正常肝细胞的形态特点,能传代培养。加入Cre重组酶逆转永生化后,肝细胞停止增生。
结论:建立了大动物肝组织四步循环灌流法分离原代肝细胞,并成功实现了用携带永生化基因SV40T的逆转录病毒转染猪原代肝细胞,获得了永生化的猪肝细胞。
人原代肝细胞的分离、培养建立一种高效利用手术切除后废弃的健康肝组织分离人原代肝细胞的方法。
方法:收集良性肝病患者外科手术切除后废弃的健康肝组织,采用我们自己建立的改良四步循环灌流法分离人原代肝细胞。同时评价获取肝组织的重量、冷热缺血时间等对肝细胞分离效果的影响。
结果:共获得13块合适的健康肝组织,其中肝血管瘤患者10例,肝内胆管结石患者3例。所有患者查HCV-Ab、HIV-Ab及HBV-Ag均为阴性。患者手术前肝功能(ALT,ALB等)均在正常水平,平均年龄47岁(23—57岁),血型:O+型4例,A+型6例,AB+型1例,B+型2例。肝组织块重量为27.2±7.8g(15—42g)。热缺血时间(WIT)10-35min,、所有13例组织块的冷缺血时间(CIT)均<35 min。分离获得的细胞产量为4.8±2.1×106/g肝组织,台酚蓝染色后用血球计数板测肝细胞活率为78.1±10.4%(62%-93%)。
结论:1,良性肝病(主要是肝血管瘤及肝内胆管结石)行部分肝切除后废弃的周边正常肝组织,可以采用改良的四步循环灌注法分离获得大量活性好的人肝细胞。
2,对于存在中度以下纤维化的肝组织,如果切缘血管条件好,仍可以有很好的细胞分离效果。
3,应尽量缩短获取肝组织的热缺血时间,提高肝细胞分离效果。
4,对于较小的肝组织块,切面血管条件欠佳者,采用四步循环灌流法分离肝细胞效果欠佳。
参考文献
[1]Human Hepatocyte Transplantation:Worldwide Results[J].Robert A.Fisher,Stephen C.Strom.Transplantation.2006(4)
[2]Which Are the Right Cells to be Used in a Bioartificial Liver?[J].Robert A.F.M.Chamuleau,Tanja Deurholt,Ruurdtje Hoekstra.Metabolic Brain Disease.2005(4)
[3]Signaling crosstalk between NF-κB and JNK[J].Hiroyasu Nakano.Trends in Immunology.2004(8)
[4]X-linked inhibitor of apoptosis(XIAP)protein protects against caspase activation and tissue loss after neonatal hypoxia–ischemia[J].Xiaoyang Wang,Changlian Zhu,Xinhua Wang,Henrik Hagberg,Laura Korhonen,Mats Sandberg,Dan Lindholm,Klas Blomgren.Neurobiology of Disease.2004(1)
[5]孟凡迎.人原代肝细胞的分离、培养及可逆性永生化[D].华中科技大学,2010.
