导读
降冰片烯 (NBE, norbornene)又称降莰烯 (norcamphene),其分子结构中具有环己烯环与亚甲基桥 (C-1与C-4之间)结构单元 (Figure 1),同时,由于环中双键的引入,将产生显著的环张力与高度的反应活性。基于降冰片烯较高的反应活性,意大利化学家M. Catellani在1997年首次报道一种采用钯/降冰片烯(Pd/NBE)协同催化的策略,成功实现各类芳香化合物的高效与区域选择性的双重官能团化反应[1]。之后,通过选择不同结构的降冰片烯衍生物,M. Lautens、余金权、T. Ritter、董广彬以及周强辉等团队进一步对于钯/降冰片烯(Pd/NBE)协同催化体系进行深入研究,进而设计出诸多全新的合成转化策略。例如钯催化的domino反应、非芳环体系参与的Catellani反应、C-H键活化实现远程手性诱导、远程C-H键活化、联芳基轴手性的构建、羰基迁移、胺化、烯基化以及各类杂环分子的构建等。充分体现出降冰片烯分子优良的反应活性与催化性能。本文中,Chem-Station小编着重介绍降冰片烯类分子合成策略的相关研究。
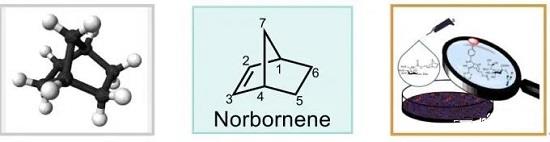
Figure 1 降冰片烯
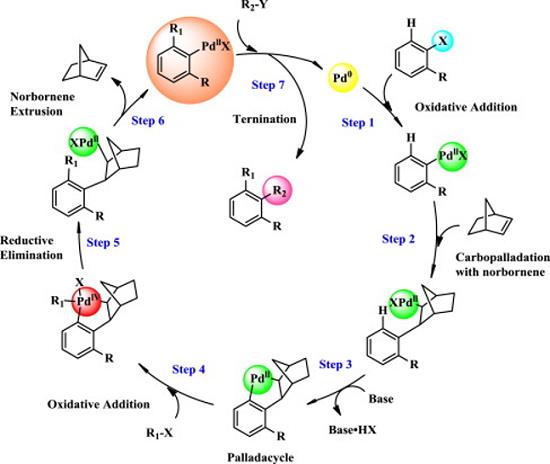
Figure 2 Catellani反应
非手性降冰片烯的合成与结构修饰
1. C1-单取代降冰片烯N1-N4的合成
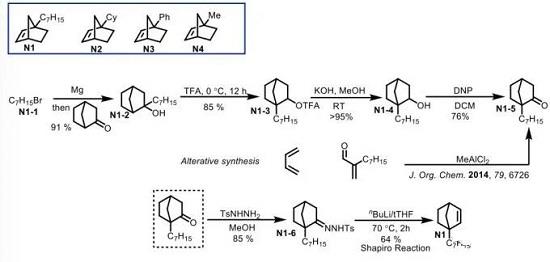
Scheme 1 降冰片烯N1的合成
降冰片烯N1的合成[2] (Scheme 1)。首先采用烷基卤代物制备的Grignard试剂与降樟脑 (norcamphor)进行亲核加成反应,形成相应的三级醇砌块,再依次经历非经典碳正离子的重排、去保护以及DNP氧化,构建起关键的中间体N1-5 (N1-5同样能够通过1, 4-丁二烯与共轭烯酮之间的D-A反应一步构建[3])。中间体N1-5与肼形成相应的腙砌块,并进一步经历后续的Shapiro反应,最终完成降冰片烯N1的合成。其他类型的降冰片烯分子N2-N4可采用类似的反应策略进行合成。
2. C1-烷基取代降冰片烯N5与C1,C4-二取代降冰片烯N6的合成
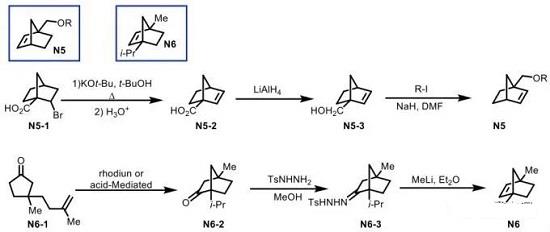
Scheme 2 降冰片烯N5-N6的合成
降冰片烯N5可通过N5-1在碱性条件下的消除与后续的还原[4]与亲核取代三步反应进行合成。而N6则通过N6-1的环化过程,形成桥环砌块N6-2 [5],之后与苯肼作用,形成相应的腙中间体N6-3,再通过后续的Shapiro反应过程,最终完成降冰片烯分子N6 的构建 (Scheme 2)。
3. C1-甲基取代的降冰片烯羧酸酯N7的合成
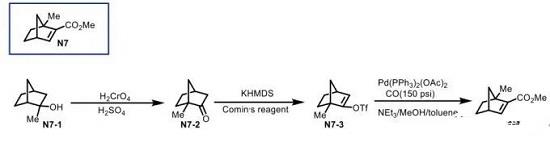
Scheme 3 降冰片烯N7的合成
降冰片烯羧酸酯N7 (Scheme 3),可通过N7-1在酸性条件下的重排以及氧化[6]过程,获得相应的N7-2砌块,再依次经历后续的烯醇化以及羰基插入反应,最终完成C1-甲基取代的降冰片烯酸酯N7的合成。
4. 降冰片烯酮N8与三氟甲基取代的降冰片烯N9的合成
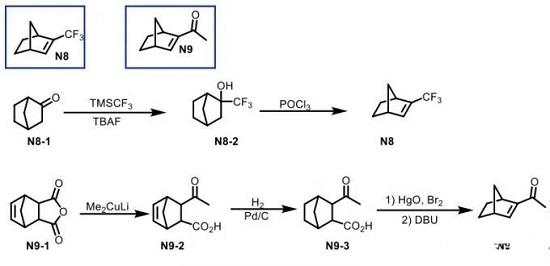
Scheme 4 降冰片烯N8-N9的合成
降冰片烯N9可通过N8-1与TMSCF3的加成以及三氯氧磷存在下的消除反应过程进行合成[7]。而N9则依次通过N9-1砌块与Gilman试剂之间的加成消除、氢化、脱羧溴代以及消除的四步反应路线进行合成[8] (Scheme 4)。
5. 降冰片烯羧酸酯及其衍生物N10-N11的合成
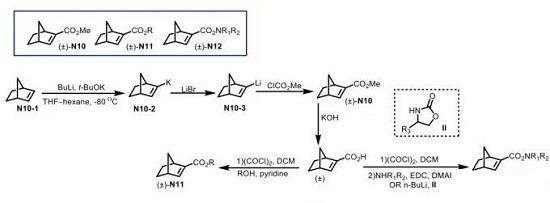
Scheme 5 降冰片烯N10-N11的合成
降冰片烯N10可通过采用N10-1作为起始原料 (Scheme 5),依次通过n-BuLi的去质子化,锂钾交换以及甲氧羰基化的三步反应路线进行合成[9]。其中,N10碱性条件下水解,形成羧酸,再分别通过草酰氯存在下的酯化与酰胺化过程[7],最终完成N11与N12分子的构建。
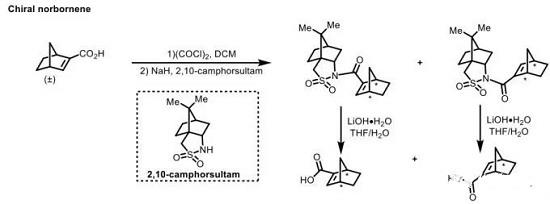
手性降冰片烯的合成
手性降冰片烯的合成,目前主要涉及动力学拆分[7]与对映选择性D-A反应两种策略[10]。
降冰片烯应用:
1.通过Tf2O促进的α-胺化过程进行的羰基1,2-重排[11] (Carbonyl 1,2-transposition through triflate-mediated α-amination)
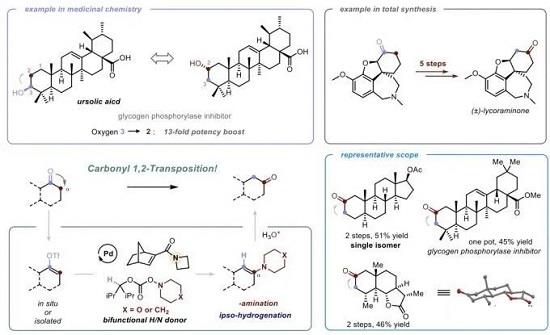
Chicago大学的董广彬团队在钯/降冰片烯(Pd/NBE)的协同催化作用下,成功开发一种简洁实用的1,2-羰基迁移策略。这一全新的羰基迁移策略具有底物应用范围广泛与良好的官能团兼容性。为γ-取代的手性酮分子与α-取代酮以及各类药物分子的后期修饰开辟出全新的反应路线。
2. 通过C-H键活化实现远程手性诱导[12] (Enantioselective remote meta-C–H arylation and alkylation via a chiral transient mediator)
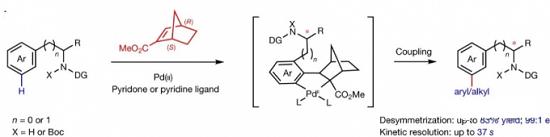
TSRI (The Scripps Research Institute)的余金权教授在钯/降冰片烯 (Pd/NBE) 催化体系的协同作用下,通过芳基化合物间位C-H键活化-去对称化的反应策略,成功在一系列芳基化合物的间位引入官能团化的芳基与烷基,同时成功在苄胺以及高苄胺分子的远程位置引入新的手性中心。
3. 通过钯/手性降冰片烯体系的协同催化实现轴手性分子的构建[13] (Construction of axial chirality via palladium/chiral norbornene cooperative catalysis)
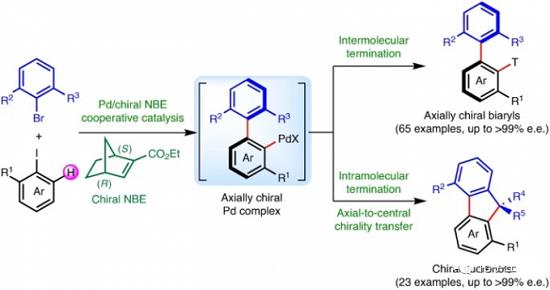
武汉大学的周强辉小组受到Catellani反应相关报道的启发,采用钯/手性降冰片烯协同催化的反应策略,顺利完成一系列轴手性联芳类分子的阻转选择性构建。
参考文献
[1] M. Catellani, F. Frignani, A. Rangoni, Angew. Chem. Int. Ed. 1997, 36, 119. doi: 10.1002/anie.199701191.
[2] J. Wang, R. Li, Z. Dong, P. Liu, G. Dong, Nat. Chem. 2018, 10, 866. doi:10.1038/s41557-018-0074-z.
[3] D. Liang, Y. Zou, Q. Wang, A. Goeke, J. Org. Chem. 2014, 79, 6726. doi: 10.1021/jo500942a.
[4] J. W. Wilt, C. T. Parsons, C. A. Schneider, D. G. Schultenover, W. J. Wagner, J. Org. Chem. 1968, 33, 694. doi: 10.1021/jo01266a047.
[5] X. Jiang, Z. Pan, C. J. Douglas, Tetrahedron. Lett. 2015, 56, 5324. doi: 10.1016/j.tetlet.2015.07.086.
[6] H. C. Brown, , M. Ravindranathan, C. Rao, F. J. Chloupek,\ Rei, M. H. J. Org. Chem. 1978, 43, 3667. doi: 10.1021/jo00413a007.
[7] R. Li, G. Dong, Angew. Chem. Int. Ed. 2018, 57, 1697. doi: 10.1002/anie.201712393
[8] X. Zhu, G. Li, F. Xu, Y. Zhang, M. Xue, Q. Shen, Tetrahedron 2017, 73, 1451. doi: 10.1016/j.tet.2017.01.051.
[9] H. D. Verkruijsse, L. Brandsma, Recl. Trav. Chim. Pays-Bas 1986, 105, 66. doi: 10.1002/recl.19861050205.
[10] K. Cao, B. Yuan, X. Liu, M. Wu, Z. Yao, Prog. Chem. 2017, 29, 605. doi: 10.7536/PC170127.
[11] Z. Wu, X. Xu, J. Wang, G. Dong, Science 2021, 374, 734. doi: 10.1126/science.abl7854.
[12] H. Shi, A. N. Herron, Y. Shao, Q. Shao, J. Yu, Nature 2018, 558, 581. doi: 10.1038/s41586-018-0220-1.
[13] Z. Liu, Y. Hua, Q. Gao, Y. Ma, H. Tang, Y. Shang, H. Cheng, Q. Zhou, Nat. Catal. 2020, 3, 727. doi: 10.1038/s41929-020-0494-1
