毒理【1】
1.氯化镉对小鼠的 LD50
预试验初步确定0%和100% 死亡剂量分别是 100.0 mg/kg 和 300.0mg/kg,r=1.25,1/r=0.8,据 此 氯 化 镉 溶 液 的 灌胃剂量由高到低依次为 300.0 mg/kg剂 量 组 (Ⅵ组)、240.0mg/kg剂量组(Ⅴ组)、192.0mg/kg剂量组(Ⅳ 组)、153.6 mg/kg 剂 量 组 (Ⅲ 组)、122.9mg/kg剂 量 组 (Ⅱ 组)和 98.3 mg/kg 剂 量 组 (Ⅰ组)。急性毒性试验 灌 胃 后2h开 始 出 现 死 亡,36h内的死亡只 数 见 表1。利 用 Bliss法 计 算 氯 化 镉 经口灌胃 LD50 的 回 归 方 程 y(Probit)= -13.859+8.3009Log(D),LD50 =187.03mg/kg,LD50(Feiller校正)95%的 可 信 区 间 为165.02~213.20 mg/kg,LD5=118.51mg/kg,LD95=295.17mg/kg。
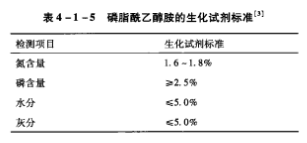
2. 氯化镉对小鼠体质量的影响
见表2。各 组小鼠的初始体质量均差异不显著(P>0.05),但其在试验期间随染毒剂量的升高而降低;3d时,除Ⅵ组小鼠100%死亡外,与对照组小鼠比较,Ⅳ 组差异显著(P<0.05),Ⅴ组差异极显著(P<0.01),其余各组均差异不显著;试验结束时,各组小鼠体质量与对照组相比,均 差 异 极 显 著(P<0.01)。在 观 察 期内,对照组3d体质量与其始体质量相比,差异不显著(P>0.05),末体质量与其始体质量相比,差异极显著(P<0.01),其余各组3d体质量和末体质量与其始体质量相比,均差异不显著(P>0.05)。
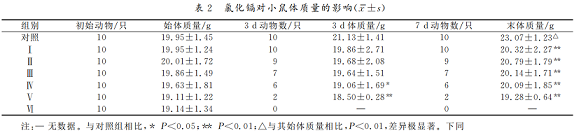
3.氯化镉对小鼠脏器指数的影响
见表3。氯化镉对各剂量组小鼠心、脾、肾指数的影响随染毒剂量的增加而呈增大趋势,肝指数和睾丸指数则有减小趋势,大脑指数和肺指数无变化。与对照组相比,Ⅰ组心指数差异不显著(P>0.05),其他各组差异显著(P<0.05),脾 指 数 和 睾 丸 指 数 差 异 极 显 著 (P<0.01),其余脏器指数均差异不显著(P>0.05)。
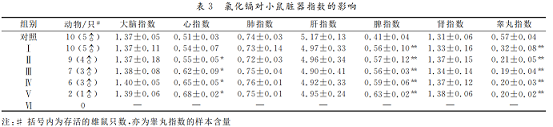
4 .氯化镉对小鼠血液生理指标的影响
见表4。各组小鼠的 WBC、RBC、HB和 HCT均在正常生理范围内波动,其中,RBC、HB和 HCT随染毒剂量的升高而降低,但与对照组相比,均差异不显著(P>0.05)。
病理剖检【1】
5.1 一般剖检变化
急性染毒后小鼠食欲下降,精神沉郁,嗜睡,反应迟钝,活动减少,行动缓慢。灌胃后2h开始出现死亡,36h后未见死亡,各剂量组死亡情况见表1。死亡小鼠心脏肥大,肺充血,肝脏质地变软,体积增大,脾脏明显肿大,大脑、肾和睾丸剖检变化不 明 显。与 对 照 组 小 鼠 比 较,存 活 小 鼠 的大脑、肺、肾剖检 变 化 不 明 显,心、肝、脾 则 与 死 亡 小鼠外观剖检相似,但睾丸组织明显萎缩。
5.2 病理组织学变化
对照组小鼠的大脑、心、肺、肝、脾、肾、睾 丸 组 织 未 见 异 常 病 变,分 别 见 图 1A1、B1、C1、D1、E1、F1和 G1。灌胃染毒后死亡的小鼠除大脑组织无明显病变(图1A2)外,其 余 各 组 织 均 有 病 理 组 织 学 变 化。尤以Ⅵ组小鼠较严重,出现心肌纤维颗粒变性,间隙增宽,肌束断裂(图1B2);肺脏间质血管和小血管充血(图1C2);肝 索 凌 乱,肝细胞颗粒变性和空泡变性(图1D2);脾 脏 充 血,图 示 红 髓 内 红 细 胞 数 量 增 多,白髓内淋巴细胞数量减少(图1E2);肾 小 管 细 胞 轻微颗粒变性,毛细血管和小血管充血(图1F2);睾丸生精上皮萎缩脱落,睾丸间质减少(图1G2)。存活小鼠随染毒剂量的增 加,各组织病变情况加重。Ⅰ组较轻微,Ⅴ组较为严重,出现大脑毛细血管数量增多,细胞凋亡数量增加(图1A3);心肌纤维
轻微颗粒变性,间隙增宽(图1B3);肺脏间质血管和小血管充血(图1C3);肝脏中央静脉充血,肝细胞轻微颗粒变性(图1D3);脾脏充血,红髓内红细胞数量增多(图1E3);肾小管细胞轻微颗粒变性(图1F3);睾丸曲精上皮萎缩,睾丸间质间隙增宽(图1G3)
致癌作用【2】
2.1 氯化镉导致 HELF 的形态学改变 阴性对照组细胞生长规整, 成束状排列, 具有明显方向性, 无重叠生长现象(图 1)。
光镜下实验组单个细胞形态并未见到改变, 但细胞群体生长方式发生变化, 次氯化镉处理后传 2代, Ⅲ组细胞发生生长杂乱倾向, Ⅰ 、Ⅱ组细胞于染镉后 4 代才出现此现象。 经第 3 次处理后,各组细胞呈紊乱性生长, 失去方向性, 有些区域的细胞相互交叉呈重叠生长(图 2), 形成明显转化灶(图 3),转化灶中央交叉堆集浓染的细胞核;周围可见细胞核的交叉;转化灶边缘可见细胞稀疏部位。 经第 3 次处理后, 各组细胞转化灶数均明显增多, 阳性对照组细胞形态变化过程基本同Ⅱ组。


2.2 氯化镉对 HELF 染色体的影响 实验组细胞染色体核型分析, 在不同程度上表现出非整倍体的特征,核型 46 条染色体的细胞约占 27%~ 45%, 其余细胞染色体数波动在 30 或 90 条左右, 并存在染色体结构畸变:断片、双着丝粒体。 实验组染色体数目畸变细胞率和结构畸变细胞率分别为 55%、58%、73%和 9%、11%、12%。 阴性对照组染色体 46 条的占 92%, 保持正常二倍体核型。 结果表明:实验组染色体数目畸变细胞率 和结 构畸变 细胞 率高 于阴 性对 照组(P <0.01)。
2.3 氯化镉对 HELF 细胞周期素 D 1 表达的影响 (附表)实验组细胞周期素 D 1 表达量增加, 与阴性对照组相比具有显著性差异(P <0.01, 但 Ⅰ 组 P<0.05),并且实验组之间差异也非常显著(P <0.01), 说明细胞周期素 D 1 表达量与染镉量之间存在着剂量反应关系。

2.4 氯化镉对HELF 突变型 P 53 蛋白表达的影响 实验组突变型 P 53 蛋白表达量均明显高于阴性对照组(P<0.01), 且Ⅰ 、Ⅱ与Ⅲ组之间差异显著(P <0.05), 但Ⅰ 、Ⅱ间差异不显著(P >0.05)
研究发现氯化镉具有致突变作用, 且是一种染色体断裂剂, 这在镉致癌机理中可能起重要作用 。 因为染色体断裂后就可能使细胞内控制其生长调节的功能基因的表达受到影响, 以致细胞生长调节系统功能失调而诱发细胞癌变。关于 P 53 的表达对镉致癌影响的报道甚少。本研究发现实验组突变型 P 53 的表达明显增高, 由此认为突变型 P 53 的表达可能是氯化镉致癌的一种机理。 氯化镉诱导的突变型 P 53 蛋白由于没有野坚生型 P 53 的功能, 且可抑制野生型 P 53 的功能, 最终可导致细胞转化和肿瘤发生。实验证明, 细胞周期素 D 1 是 G 1 /S 限制点的正调节子, 适量的细胞周期素 D 1 是细胞分裂所必需的, 而细胞周期素 D 1 的过表达, 则干扰细胞周期进程, 导致细胞过度增殖。 本研究发现各实验组细胞周期素D 1 表达量均高于阴性对照组, 说明细胞周期素 D 1 的过表达在镉致癌机理中起一定作用。有研究表明 G 1 /S 限制点调控机制涉及到细胞周期素 D 1 , 细胞周期素依赖激酶 4(CDK 4 )、P 53 、CDK 抑制蛋白(P 21 蛋白)的相互作用。 一方面细胞周期素 D 1的过表达可克服 P 21 蛋白抑制细胞生长的作用 ;另一方面, 突变型 P 53 不具有诱导 P 21 蛋白的功能, 因而也不能发挥 P 21 抑制细胞增殖的作用。 研究结果表明:氯化镉处理后, 突变型 P 53 蛋白和细胞周期素 D 1 均明显增高, 说明氯化镉致癌机理中可能存在二者的协同作用。
参考文献
[1]杨雪峰,葛亚明,姜金庆,徐之勇,崔艳红,王自良.氯化镉对小鼠的急性毒性效应[J].中国兽医学报,2012,32(03):467-471.
[2]王晓丽,李永安,冯彪,凌翎,李志超,郭丽,范洪学.氯化镉致癌机理的研究[J].中国公共卫生学报,1999(02):33-35.
