背景及概述[1]
α-葡萄糖苷酶,又称葡萄糖基转移酶(α-glucosidase,EC.3.2.1.20),系统命名为 α-D-葡萄糖苷葡萄糖水解酶。它在糖的催化反应中具有水解和转糖苷的双重作用。水解作用可从α-葡萄糖苷、寡糖和葡聚糖的非还原性末端切开α-1,4糖苷键,释放出葡萄糖;转糖苷作用又可将游离出的葡萄糖残基以α-1,6糖苷键转移到另一个葡萄糖或麦芽糖类底物上,从而得到非发酵性的低聚异麦芽糖(简称IMO)。
制备[1]
自20世纪80年代日本从黑曲霉中筛选出α-葡萄糖苷酶生产菌种,并得以工业化生产酶制剂以来,α-葡萄糖苷酶在基础研究和工业生产上发挥着越来越重要的作用。目前,国外生产的α-葡萄糖苷酶大部分为纯酶,酶活较高;而国内主要以粗酶液为主,酶活较低。而且,国内尚未有商品化α-葡萄糖苷酶酶制剂出售,用于生产的酶均来自国外少数几个酶制剂厂,进口价格昂贵,导致IMO的生产成本居高不,一定程度上制约了我国IMO产业的发展。
选育α-葡萄糖苷酶的高产菌种并建立相应的高效制备工艺是实现α-葡萄糖苷酶低成本商 业化制造的关键所在。CN201710281060.9提供一种α-葡萄糖苷酶的高效制备方法。
以微生物或植物来源的α-葡萄糖苷酶基因碱基序列为依据,参考目标宿主菌的密码子偏好性进行密码子优化, 并通过采用长引物和低温易错PCR的筛选获得催化性能显著提升的α-葡萄糖苷酶编码基因,然后再通过引入强启动子和高分泌效率信号肽等元件,借助重构的表达质粒增加α-葡萄糖苷酶基因拷贝数,获得了高效分泌表达α-葡萄糖苷酶的重组菌,结合酶活力差异性筛选获得活力最高的菌株。结合该菌株的生长特征和产酶特征建立30m3发酵体系下的α-葡萄 糖苷酶高效分泌表达工艺。
实施例:α-葡萄糖苷酶编码基因在毕赤酵母中的克隆和表达
以黑曲霉Aspergillus niger CICIM F0215菌株(江南大学中国高校工业微生物资源 与信息中心http://cicim-cu.jiangnan.edu.cn)为出发菌株进行培养,收集菌体。采用 TRNzol总RNA提取试剂提取它们的总RNA。以总RNA为模板,参照RT-PCR试剂盒说明书,以 oligo (dT)为引物逆转录合成链cDNA。分别以染色体DNA或链cDNA为模板,使用引物(SEQ ID NO. 2~SEQ ID NO.13;相邻的两个为一对上下游引物)进行PCR扩增出α-葡萄糖苷酶的编码基因agA、agB、agC、agD、agE和agF。
PCR反应条件如下:94℃预变性5 min;94℃ 30 s,61℃ 30 s,72℃ 2 min,30个循环;72℃延伸10 min。将PCR产物与质粒pPIC9K分别用SnaB I和EcoRI进行酶切、纯化,再进行连接,转化Escheriachia coli JM109感受态细胞。用含有氨苄青霉素的LB固体培养基筛选阳性转化子,并提取其质粒,用限制性内切酶酶切进行验证。毕赤酵母的遗传转化及筛选:分别将构建成功的6个重组质粒pPIC9K-agA、pPIC9K-agB、pPIC9K-agC、pPIC9K-agD、pPIC9K-agE和pPIC9K-agF(图4)用Sac I或Sal I进 行单酶切线性化。
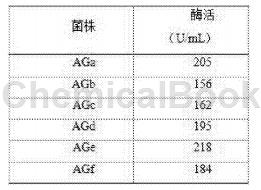
酶切产物经纯化回收后电转化转化Pichia pastoris GS115,均匀涂布于 MD平板,30℃恒温培养至单菌落形成。挑取多个单克隆重组酵母分别接种于终浓度为0.5、2 mg/mL G418的YPD平板上进行筛选,30℃培养箱培养至长出单菌落,挑取生长情况好的重 组酵母菌株保存,并分别对这6株重组菌进行命名AGa、AGb、AGc、AGd、AGe和AGf。采用毕赤酵母操作手册给定的培养方法和甲醇诱导发酵方法制备相应的α-葡萄糖苷酶酶液。
(1)将筛选的重组酵母菌株与对照菌株毕赤酵母GS115进行划线活化,挑取单菌落 分别接种到50 mL YPD液体培养基中(含有终浓度为50 μg/mL卡那霉素),30℃、180 r/min 培养16~18 h;
(2)按1%接种量分别接入50 mL BMGY 液体培养基中(含有终浓度为50 μg/mL卡那霉 素),30℃,180 r/min培养至OD600=2~6 (约16~18小时);
(3)收集菌液于灭菌的50 mL离心管中,8000 r/min,离心5 min,倒掉上清,用1/5-1/10 原培养基体积的BMMY重悬细胞,使菌体的OD600=1进行培养,加入甲醇至终浓度为0.5%进行诱导,放入30℃摇床继续培养;
(4)发酵96小时取样测酶活(按照前述方法进行测定),并加入甲醇至终浓度为0.5%进行诱导。测定酶活列于表1。表1重组毕赤酵母中α-葡萄糖苷酶的合成水平
主要参考资料
[1] CN201710281060.9 一种α-葡萄糖苷酶的高效制备方法
