美国罗格斯癌症研究所Bannerji等报告,Odronextamab单药治疗的安全性可控且有令人鼓舞的初步抗瘤活性,其对多线治疗失败的B细胞非霍奇金淋巴瘤患者有持久疗效,支持进一步研究。(Lancet Haematol. 2022年4月1日在线版)
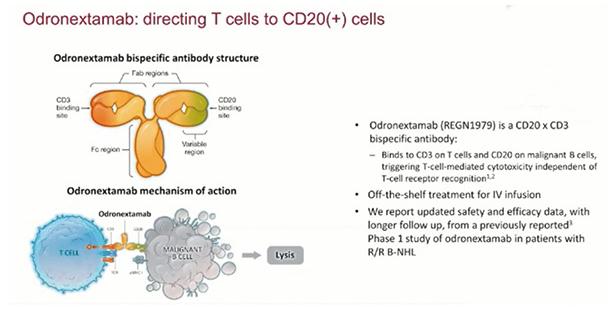
Odronextamab 是一种铰链稳定的、全人源化的IgG4型CD20 × CD3双特异性抗体,可结合T细胞上的CD3和B细胞上的CD20。为了评估Odronextamab在复发或难治性B细胞非霍奇金淋巴瘤患者中的安全性和抗肿瘤活性,该项单臂、多中心、Ⅰ期剂量递增和剂量扩展研究(ELM-1)在美国和德国的10个学术中心入组此类患者。
根据递增给药方案,患者第1个周期接受Odronextamab,在第2~4个周期(每个周期为21天)以0.1~320 mg的目标剂量每周治疗一次,从第5个周期开始每2周进行一次维持治疗,直至疾病进展或出现不可耐受的毒性。
入组条件:≥18岁;CD20阳性复发性或难治性B细胞恶性肿瘤,曾接受过靶向CD20的抗体治疗,且至少有一个可测量的病变;ECOG PS评分为0~1。主要的安全性终点为不良事件发生率和剂量限制性毒性。次要终点为客观缓解率。
结果显示,2015年2月4日至2021年9月25日,研究入组145例多线(中位3线,四分位距为2~5线)治疗失败的患者,其中94例纳入剂量递增队列,51例纳入剂量扩展队列。
患者的中位年龄为67.0岁;男性101例(70%),女性44例(30%);白人119例(82%),非西班牙裔或拉丁裔132例(91%)。42(29%)例接受过CAR T治疗,119(82%)例末线治疗失败。中位随访4.2个月(IQR:1.5~11.5个月)。
在剂量递增队列,Odronextamab给药至剂量 320 mg q7,未见剂量限制性毒性。在剂量扩展队列,1~3a级滤泡性淋巴瘤的推荐剂量为80 mg,弥漫性大B细胞淋巴瘤的为160 mg。细胞因子释放综合征和神经系统治疗中出现的不良事件主要是低级别症状,且未导致治疗中断。
最常见的≥3级的治疗中出现的不良事件为贫血(36例,25%)、淋巴细胞减少(28例,19%)、低磷血症(27例,19%)、中性粒细胞减少(27例,19%)和血小板减少症(20例,14%)。
145例中有89例(61%)发生了严重的治疗中出现的不良事件,最常见的为细胞因子释放综合征(41例,28%)、发热(11例,8%)、肺炎(9例,6%)和输液相关反应(6例,4%)。4例死亡与治疗有关分别死于淋巴瘤累及胃部导致的胃穿孔、肺部感染、肺炎和肿瘤溶解综合征。
客观缓解率为51%(95%CI 42%~59%)。在剂量≥ 5 mg的滤泡性淋巴瘤患者中,客观缓解率为91%(95%CI 75%~98%),完全缓解率为72%(95%CI 53%~86%)。在未接受过CAR T细胞疗法的、剂量≥ 80 mg的弥漫性大B细胞淋巴瘤患者中,客观缓解率为53%,且均为完全缓解。在接受过CAR T细胞疗法且剂量≥80 mg的弥漫性大B细胞淋巴瘤患者中,客观缓解率为33%,完全缓解率为27%
