背景及概述
(1R,3S,4S)-N-叔丁氧羰基-2-氮杂双环[2.2.1]庚烷-3-羧酸(1),是一种重要的脯氨酸类似物,在多肽化学、不对称催化合成和药物中间体合成等领域均有广泛应用。近年来,随着抗丙肝新药研究的兴起,1 开始用于 HCVNS3/4A 蛋白酶拟肽类抑制剂的合成。目前,该类抗丙肝新药已进入临床研究阶段。
制备
1 的合成报道相对较少。以(R)-( + )-#-甲基苄胺和乙醛酸酯为原料,苯-甲苯为溶剂,经回流反应制得 (R,Z)-乙基 2-[(1-苯乙基)亚胺]羧酸酯; 在三氟化硼乙醚催化下于 - 78℃ 与环戊二烯发生氮杂Diels-Alder 反应制得(1S,3S,4R)-乙基 2-[(S)-1-苯乙基]-2-氮杂双环[2.2.1]庚-5-烯-3-羧酸酯;经还原、缩合和水解等反应合成 1[1],总收率 5% ~50%。该路线涉及高毒性溶剂(苯)和敏感试剂(三氟化硼乙醚),反应条件较苛刻 ( 高温和-78 ℃),不利于放大生产。
本文在文献方法基础上,对合成 1 的几步关键反应进行了探索和改进。以(R)-( + )-#-甲基苄胺为起始原料,DCM 为溶剂,无水硫酸钠为脱水剂,于 0 ℃与乙醛酸乙酯反应制得(R,Z)-乙基 2-[(1-苯乙基)亚胺]羧酸酯;在三氟乙酸催化下与环戊二烯发生 Diels - Alder 反应制得(1S,3S,4R)-乙基 2-[(S)-1-苯乙基]-2-氮杂双环[2.2.1]庚-5-烯-3-羧酸酯;经钯碳催化-还原,脱除苄基制得(1R,3S,4S)-乙基 2-氮杂双环[2.2.1]庚烷-3-羧酸酯; 用 Boc 保护得(1R,3S,4S)-2-苄基 3-乙基 2-氮杂双环[2.2.1]庚烷-2,3-二羧酸酯; 经水解合成(1R,3S,4S)-N-叔丁氧羰基-2-氮杂双环[2.2.1]庚烷-3-羧酸,总收率66%,其结构经 1 H NMR 和 ESI-MS 确证。
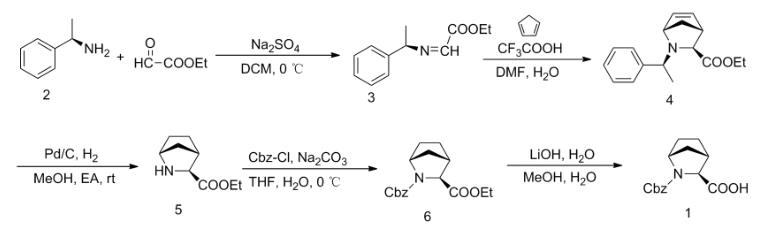
图1 (1R,3S,4S)-N-叔丁氧羰基-2-氮杂双环[2.2.1]庚烷-3-羧酸的合成路线图
实验操作:
3 的合成
在干燥的圆底烧瓶中依次加入乙醛酸乙酯36.0 g(353 mmol),DCM 200 mL 和无水硫酸钠60.2 g,搅拌下于0 ℃滴加240.6 g(335 mmol),滴毕,反应5 h。抽滤,滤液旋干溶剂,用石油醚(2 ×100 mL) 洗涤得黄色液体 366.6 g,收率 97%;1 H NMR δ: 7. 72(m,1H),7.34(m,4H),7.27(m,1H),4.61(q,J = 6.7 Hz,1H),4.34(qd,J =7.1Hz,2.6 Hz,2H),1. 62(d,J = 6. 7 Hz,3H),1.34(t,J = 7.1 Hz,3H); ESI-MS m/z:206.1{[M +H]+}。
4 的合成
在干燥的圆底烧瓶中依次加入 3 1.5 g(300mmol),DMF 200 mL,CF3CO2H 23.5 mL,环戊二烯 40.0 g(600 mmol)和水 1 mL,搅拌下于室温反应过夜。倒入 NaOH 溶液(500 mL)中,分液,水相用 DCM(3 ×100 mL)萃取,合并有机相,用无水硫酸钠干燥,减压蒸除溶剂,残余物经柱色谱[洗脱剂 A: V(PE) ∶ V(EA) = 20 ∶ 1]纯化得黄色液体 462.6 g,收率 77%;1 H NMR δ: 7. 28(m,2H),7.18(m,3H),6.42(s,1H),6.26(d,J =5.4 Hz,1H),4.31(s,1H),3.80(dd,J = 7.1Hz,3.6 Hz,2H),3. 03(q,J = 6.4 Hz,1H),2.90(s,1H),2.21(s,1H),2.12(d,J =8.3 Hz,1H),1.41(d,J =6.6 Hz,4H),0.94 (t,J =7. 1Hz,3H); ESI-MS m/z: 272.2{[M +H]+}。
5 的合成
在干燥的圆底烧瓶中依次加入 4 40. 7 g(150mmol),混合溶剂[V(MeOH)∶ V(EA) =1 ∶2]300 mL和10%Pd/C 5.0 g,于 3 MPa 氢压下反应过夜。滤除 Pd/C,滤液旋干溶剂得橙黄色液体5 25.5 g,收率99%;1 H NMR δ:4.18(q,J =7.1 Hz,2H),3.58(s,1H),3.35(s,1H),2. 64(s,1H),2. 15(s,3H),1.60 ~1. 40(m,4H),1. 28(d,J = 7. 2 Hz,3H);ESI-MS m/z: 170.1{[M +H]+ }。
6 的合成
在干燥的圆底烧瓶中依次加入 533.9 g(200mmol),THF 200 mL,碳酸钠25.5 g 和水100 mL,搅拌 下 于 0 ℃ 缓慢滴加 Boc-Cl 30 mL (210mmol),滴毕(2 ~3 h),于室温反应过夜。加入冰水 300 mL,分液,水相用 DCM(3 ×100 mL)萃取,合并有机相,用无水硫酸钠干燥,减压蒸除溶剂,残余物经柱色谱(洗脱剂:A =20 ∶ 1)纯化得无色油状液体 656.4 g,收率 93%;1 H NMR δ: 7.37(m,3H),7.30(m,2H),5.11(ddd,J = 49.5Hz,24.7 Hz,10.4 Hz,2H),4.38(d,J = 26.8Hz,1H),4.11(m,2H),3.85(d,J =23.2 Hz,1H),2.70(s,1H),1.95(d,J =10.0 Hz,1H),1.76(m,1H),1.65(m,1H),1.51(dd,J =7.5Hz,4.4 Hz,1H),1.30 ~1.14(m,5H); ESI-MSm/z: 304. 2{[M + H] + }。
(1R,3S,4S)-N-叔丁氧羰基-2-氮杂双环[2.2.1]庚烷-3-羧酸的合成
在干燥的圆底烧瓶中依次加入 656.0 g(185mmol),甲醇 200 mL,水 100 mL 和 LiOH·H2O约14.0 g,搅拌下于室温反应过夜。倒入水(300mL)中,用 1 mol·L-1 盐酸调至 pH 3,分液,水相用 DCM(3 ×100 mL)萃取,合并有机相,用无水硫酸钠干燥,减压蒸除溶剂,用混合溶剂(A =3 ∶ 1)重结晶得无色液体 148.8 g,收率 96%;1 H NMRδ: 7.37(m,4H),7.29(m,1H),5.20(s,2H),4.28(s,1H),3.91(s,1H),2.98(s,1H),1.81(m,2H),1.66(dd,J =9.8 Hz,4.3 Hz,2H),1.49(m,1H),1.40(d,J =10.3 Hz,1H); ESI-MS m/z: 276.1{[M + H] + }。
结果与讨论
合成. 3 时,用硫酸钠为除水剂,避免了文献[1] 所使用的高温回流带水法,同时用 DCM 替换混合溶剂(苯-甲苯),毒性较小,收率较高。合成 4 时,用三氟乙酸和少量水代替三氟化硼乙醚,反应温度为室温,可大大降低生产成本,提升反应安全性,收率较高。合成 6 时,用碳酸钠替代氢氧化钠,收率由 70%提高至 93%。
结论
以(R)-( + )-#-甲基苄胺为原料,合成了(1R,3S,4S)-N-叔丁氧羰基-2-氮杂双环[2.2.1]庚烷-3-羧酸(1)。该反应操作简便,条件温和,成本较低,总收率由 50% 提高至 66%,是一种较好的合成(1R,3S,4S)-N-叔丁氧羰基-2-氮杂双环[2.2.1]庚烷-3-羧酸的方法。
参考文献
[1]Brandt P,Andersson P G. Exploring the chemistry of 3-substituted 2-azanorbornyls in asymmetric catalysis[J]. Synlett,2000,8:1092 -1106.
