简介
4,6-二氯-5-氟嘧啶化合物对环境污染小、价格低、稳定性好且具有过渡金属的特性,目前已被广泛应用于工业化学、农业化学以及医药品化学中,作为选择性氧化剂和绿色环保偶联试剂在多种氧化反应、重排反应、胺基化反应以及代替过渡金属进行催化反应中扮演着重要角色[1-3]。
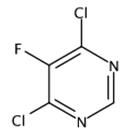
图1 4,6-二氯-5-氟嘧啶的结构式。
合成
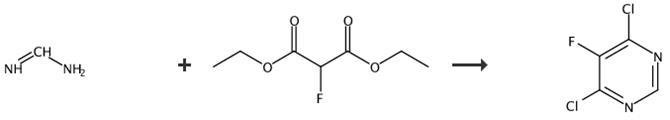
图2 4,6-二氯-5-氟嘧啶的合成路线[4]。
步骤1:在0℃下向搅拌的乙酸甲脒(1当量)在乙醇(50体积)中的溶液中加入乙醇钠在乙醇(2%重量/重量)(3当量)中的混合物,并将反应混合物在该温度下搅拌30分钟。向所得混合物中加入氟丙二酸二乙酯(1eq)在乙醇(5vol)中的溶液,并将反应混合物在室温下搅拌72小时。将反应混合物冷却至0°C,并加入浓HCl(3vol)以将反应混合物的pH调节至pH6。过滤所得沉淀物,用异丙醇、乙醚和己烷洗涤以提供所需中间体,该中间体用于下一阶段,无需进一步纯化最终产物。
步骤2:向N,Nd二甲基苯胺(leq)在磷酰氯(4vol)中的搅拌溶液中加入5-氟-嘧啶-4,6-二醇(leq,5-fluoro-pyrimidine-4,6-diol),并将反应混合物加热回流16小时。冷却至室温后,真空除去溶剂,将所得残留物倒入冰中。然后用EtOAc提取所需中间体。有机层用MgSO4干燥,过滤,真空除去溶剂,得到所需的中间体,该中间体用于下一阶段,无需进一步纯化。最终得到产品4,6-二氯-5-氟嘧啶。合成路线如图2所示。
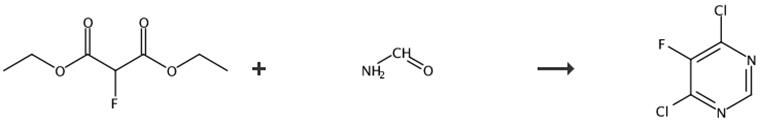
图3 4,6-二氯-5-氟嘧啶的合成路线[5]。
步骤1:向配有磁力搅拌器、氮气流和回流冷凝器的三颈5升圆底烧瓶中加入以下物质:甲醇钠(25%NaOMe甲醇溶液)(1.425升,6.230摩尔)和甲酰胺(0.535升,13.5摩尔),在氮气下加热至64℃。使用添加漏斗(反应放热)将2-氟丙二酸二乙酯(CAS#685-88-1,0.266 L,1.684 mol)缓慢添加到反应混合物中。将反应物在64℃下加热72小时。将反应物冷却至室温,并在减压下除去溶剂。残留物通过冰浴冷却至0°C。搅拌混合物并用10N HCl缓慢酸化至pH 1-2。沉淀出产物并过滤。用冰冷的1N HCl洗涤产物。将灰白色固体悬浮在ACN中,过滤并在30°C下干燥(真空烘箱)16小时,得到5-氟嘧啶-4,6-二醇。浅棕色粉红色固体,产率349.4克,2.686摩尔,160%。1H NMR(400 MHz,DMSO-d6)δppm 7.9(s,1H),12.3(brs,2H)。
步骤2:在室温下向含有5-氟嘧啶-4,6-二醇(276.459克,2.125摩尔)的2升三颈圆底烧瓶中缓慢加入磷酰氯(0.593升,6.376摩尔)以形成浆料。使用加料漏斗(放热)非常缓慢地将N,N-二甲基苯胺(81 mL,0.638 mol)加入该浆料中,并在110℃下继续反应6 h。6小时后,将反应混合物冷却至室温,并在搅拌下缓慢加入盐水和冰(2L)中。水层(红色)用DCM(2 x 2 L)萃取。合并的有机层用冷的6N HCl(蜂蜜棕色)(2x1L)洗涤,并用饱和NaHCO3(1L)洗涤。将有机层干燥(Na2SO4),通过玻璃纤维纸真空过滤,并在减压(无热)下除去溶剂,得到4,6-二氯-5-氟嘧啶,产率347.9克,2.084摩尔,98%。1H NMR(400 MHz,DMSO-d6)δppm 8.8(s,1H)。合成路线如图3所示。

图4 4,6-二氯-5-氟嘧啶的合成路线[6]。
将含5-氟嘧啶-4,6-二醇(276.459 g, 2.125 mol)的2 L三颈圆底烧瓶在室温下缓慢加入磷酰氯(0.593 L, 6.376 mol)形成浆液。将N,N-二甲基苯胺(81 mL, 0.638 mol)通过加料漏斗(放热)缓慢地加入到该浆液中,并在110°C下继续反应6 h。6 h后将反应混合物冷却至室温,搅拌后慢慢加入盐水和冰(2 L)中。用二氯甲烷 (2 × 2 L)提取水层(红色),结合有机层用6 N HCl(蜜棕色)(2 × 1 L)和sat NaHCO3 (1 L)洗涤,有机层干燥(Na2SO4),用玻璃纤维纸真空过滤,减压(无热)脱除溶剂,得到4,6-二氯-5-氟嘧啶。琥珀油,产率347.9 g, 2.084 mol, 98%。1H NMR (400 MHz, DMSO-d6) δ ppm 8.8 (s, 1H)。合成路线如图4所示。
应用
4,6-二氯-5-氟嘧啶是嘧啶类化合物中的重要成员,作为有机合成的试剂或催化剂不仅普遍应用于各类氧化反应中,还广泛应用于碳-碳键、碳-杂键及杂-杂键的形成,碳-氢键的活化、重排以及裂解等反应中[7],在医药中间体的制备和天然产物的全合成中扮演着非常重要的角色,已发展成为一种拓展新型合成方法学的重要试剂[8]。
参考文献
[1] A. Converso, A. El Marrouni, A. Forster, J.L. Frie, D.N. Hunter, C. Wang, D. Wang, Pyridinone derivatives as selective cytotoxic agents against HIV infected cells and their preparation, Merck Sharp & Dohme Corp., USA . 2020, p. 111pp.
[2] E. Defossa, H. Glombik, U. Heinelt, H. Matter, M. Mendez-Perez, N. Rackelmann, K. Ritter, L. Schwink, H. Szillat, G. Zech, Preparation of isoxazolidines as RIPK1 inhibitors and use thereof, Sanofi, Fr. . 2021, p. 378pp.
[3] P.S. Nair, G.B. Gudade, M.B. Tryambake, C.S. Pawar, D.R. Lagad, C.P. Kulkarni, M.D. Sindkhedkar, V.P. Palle, R.K. Kamboj, Preparation of substituted bicyclic heterocyclic compounds as PRMT5 inhibitors, Lupin Limited, India . 2020, p. 178pp.
[4] D.M. Panchal, P.K. Tandel, Process for the preparation of fluoxastrobin and intermediates thereof, UPL Limited, India . 2021, p. 39pp.; Chemical Indexing Equivalent to 177:374593 (IN).
[5] D.M. Panchal, P.K. Tandel, Process for the preparation of fluoxastrobin and intermediates thereof, UPL Limited, India . 2022, p. 40pp.; Chemical Indexing Equivalent to 177:103475 (WO).
[6] N. Papaioannou, J.M. Travins, S.J. Fink, J.M. Ellard, A. Rae, J.A. Spencer, S.S. Rankin, R.S.L. Chapman, Heteroaryl compounds as inhibitors of plasma kallikrein and their preparation, Shire Human Genetic Therapies, Inc., USA . 2022, p. 815pp.
[7] M. Zhu, Y. Xiao, J. Gu, J. Chen, Preparation of 4,6-dichloro-5-fluoropyrimidine, Jiangsu Zhongyuan Chemical Co., Ltd., Peop. Rep. China . 2022, p. 4pp.
[8] M. Zhu, X. Zhou, D. Yang, Y. Xiao, H. Bao, Production method and device of crude drug intermediate 4, 6-dichloro-5-fluoropyrimidine, Jiangsu Zhongyuan Chemical Co., Ltd., Peop. Rep. China . 2022, p. 14pp.
