简介
3,5-二甲基金刚胺具有活泼的反应性和特殊的溶解能力,可用作有机合成原料,纸张处理剂,纤维工业的柔软剂,动物胶的软化剂,还用作测定大米中残留物含量的分析试剂。在有机合成中,3,5-二甲基金刚胺医药方面的用途居多,在农药、染料,颜料,香料,助剂方面也有很多用途[1-2]。
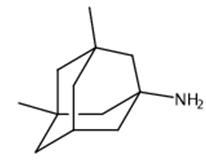
图1 3,5-二甲基金刚胺的结构式。
合成
![图2 3,5-二甲基金刚胺的合成路线[3]。 图2 3,5-二甲基金刚胺的合成路线[3]。](/NewsImg/2022-12-13/6380655900549307889077334.jpg)
图2 3,5-二甲基金刚胺的合成路线[3]。
1-甲酰胺基-3,5-二甲基金刚烷-1-甲酰胺基-3,5-二甲基金刚胺(工业级,纯度70%,2mmol,按100%纯度计算)的水解分别用选定的碱(6mmol)在选定的溶剂(10ml)或溶剂系统(10ml。通过在实施例中所示的时间之后取等分试样来监测反应。所述等分试样在甲苯和水之间分配。分离有机相并用无水Na2SO4干燥,并通过气相色谱法进行分析确证所得化合物为3,5-二甲基金刚胺。此外,实验人员用“一锅法”合成3,5-二甲基金刚胺,在三乙胺存在下以甲苯作溶剂、邻碘苯酚与丙炔酸乙酯反应,使用这种方法有效避免了在反应过程中使用毒性较大的重氮类化合物的问题,反应步骤少,时间短,操作简便,收率较高,还能更便捷地对目标化合物进行分子结构改造和修饰,对类似化合物的合成具有指导作用。
作用
3,5-二甲基金刚胺类化合物结构稳定,通过在常规液晶化合物的结构设计中引入金刚胺单元,可以降低液晶单体的熔点和清亮点,其低温互溶性好,可以提供比较宽的使用环境温度范围,将其用于混晶配方中,可明显改善液晶材料的性能,可广泛应用于不同种类的液晶显示器中[4]。随着3,5-二甲基金刚胺类化合物的作用被人们逐渐的发现,其合成方法也在不断的更新改进。有研究者使用磁性固体碱做催化剂,无溶剂法合成里3,5-二甲基金刚胺类化合物,为合成此类化合物提供了新的催化剂选择方向,该方法使用无溶剂球磨法反应,无需机械式搅拌,可以大大节省反应成本。
3,5-二甲基金刚胺其主要用途充当药物合成的中间体,由于金刚胺结构的特殊活性,在新药开发中充当着重要角色[7]。根据现有文献,5-氯噻吩-2-羧酸在驱虫药、抗艾滋病毒药、抗乙肝病毒及抗感冒药、抗风湿药、抗组胺药、抗糖尿病药及抗癌症药等数万种药物合成中可能扮演着重要角色[5]。
毒性
3,5-二甲基金刚胺+对云龙石斑鱼幼鱼的CS为0.0162 mg/L;Cu暴露诱发实验鱼的肝脏组织血窦扩张;鳃组织出现动脉瘤以及顶部棒状等现象;与对照组相比,3,5-二甲基金刚胺浓度升高,肝脏组织总超氧化物歧化酶(SOD)活力显著下降;谷草转氨酶(GOT)活力先上升后下降;随Cu处理浓度升高,肝脏、鳃组织MT-2基因表达水平均逐渐上升;而脑组织中MT-2表达水平先上升后下降,但低浓度组较对照组差异不显著。结果表明,高浓度的3,5-二甲基金刚胺会造成云龙石斑鱼幼鱼的组织损伤、免疫酶活力降低等一系列不利影响,结果为云龙石斑鱼养殖生产过程中利用3,5-二甲基金刚胺制剂防控病害的适宜剂量选择提供依据[6-7]。
贮存方法
3,5-二甲基金刚胺应贮存在干燥清洁避光的环境中,严禁3,5-二甲基金刚胺与有毒物质混放,以免污染。储存于阴凉、通风的库房。远离火种、热源、水源。3,5-二甲基金刚胺应与氧化剂分开存放,切忌混储。配备相应品种和数量的消防器材。储区应备有泄漏应急处理设备和合适的收容材料。
参考文献
[1] S. Ono, Y. Yokota, S. Ito, K. Mikami, Regiocontrolled Heptafluoroisopropylation of Aromatic Halides by Copper(I) Carboxylates with Heptafluoroisopropyl-Zinc Reagents, Org. Lett. 21(4) (2019) 1093-1097.
[2] X. Wu, K. Qiao, H. Qin, D. Zhang, D. Gao, Z. Yang, Z. Fang, K. Guo, Silver(I)-mediated oxidative C(sp3)-H amination of ethers with azole derivatives under mild conditions, Org. Chem. Front. 6(15) (2019) 2672-2677.
[3] V.A. Brotsman, A.A. Eliseev, D.I. Petukhov, A.A. Poyarkov, A.V. Lukashin, Production of modified nanoporous polymer membrane with improved water-repellent properties for membrane contactors, FGBOU VO "Moskovskii Gosudarstvennyi Universitet im. M. V. Lomonosova", Russia . 2020, p. 15pp.
[4] N.S. Bystrov, A.V. Emelianov, A.V. Eremin, B.I. Loukhovitski, A.S. Sharipov, P.I. Yatsenko, Monomolecular decomposition of C3F7I and CF3I: theory meets experiment, J. Phys.: Conf. Ser. 1556(XXXIV International Conference on Interaction of Intense Energy Fluxes with Matter, 2019) (2020) 012037.
[5] J.-b. Xu, S.-w. Liu, C.-x. Guo, L.-b. Xu, L.-f. Ban, H.-f. Wu, Synthesis and Insecticidal Activity of Broflanilide, Nongyao 59(1) (2020) 14-17.
[6] W.P. Gallagher, J.R. Coombs, C.A. Guerrero, D. Marcoux, Q. Shi, C.L. Joe, S. Rupasinghe, J.J. Zhu, S. Kalidindi, S. Shunmugaraj, M. Kandasamy, S.S. Bondigela, R. Vaidyanathan, S.T. Tendulkar, S. Kuppusamy, F. Gonzalez-Bobes, Preparation of chiral RORγt antagonist intermediates, Bristol-Myers Squibb Company, USA; Syngene International Limited . 2022, p. 16 pp.
[7] L. Chen, A. Ji, Y. Wu, toxicity of 3, 5-dimethylamine, Nanjing Polytechnic Institute, Peop. Rep. China . 2022, p. 6pp.
