巴洛沙韦(Baloxavir,即玛巴洛沙韦,速福达)由日本盐野义制药研发,设计思路来源于对HIV整合酶抑制剂多替拉韦的改造。
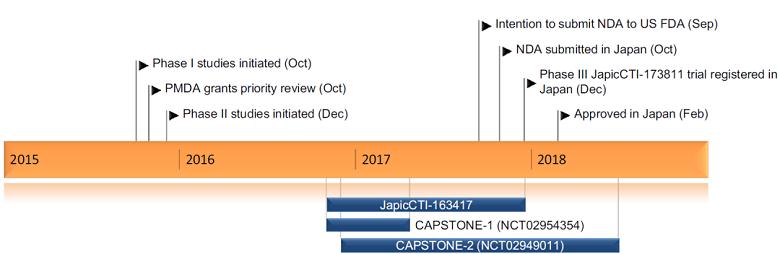
图1.巴洛沙韦研发历程
2018年2月,巴洛沙韦在日本获批上市,用于治疗12岁以上患者的甲型和乙型流感病毒感染。同年12月,FDA批准巴洛沙韦上市。
2021年4月,巴沙洛韦在国内获批上市,同年12月被纳入医保药品目录。
巴洛沙韦作用机制
巴洛沙韦的全称是巴洛沙韦马波西酯(Baloxavir Marboxil),为前药,在体内经芳基乙酰胺脱乙酰酶代谢后转化为活性形式巴洛沙韦酸。
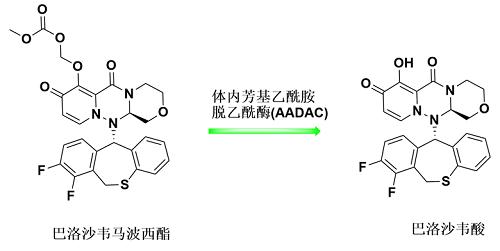
图2.巴洛沙韦体内代谢
奥司他韦的作用机制是通过将流感病毒“囚禁”在宿主细胞内防止病毒继续感染,而巴洛沙韦的作用机制则是抑制病毒RNA聚合酶(帽依赖性核酸内切酶)。
流感病毒作为负链RNA病毒,入侵宿主细胞后并不能以自身为模板直接进行复制和转录,而是先合成互补的mRNA(包括cRNA),随后再进行转录/翻译及组装过程。
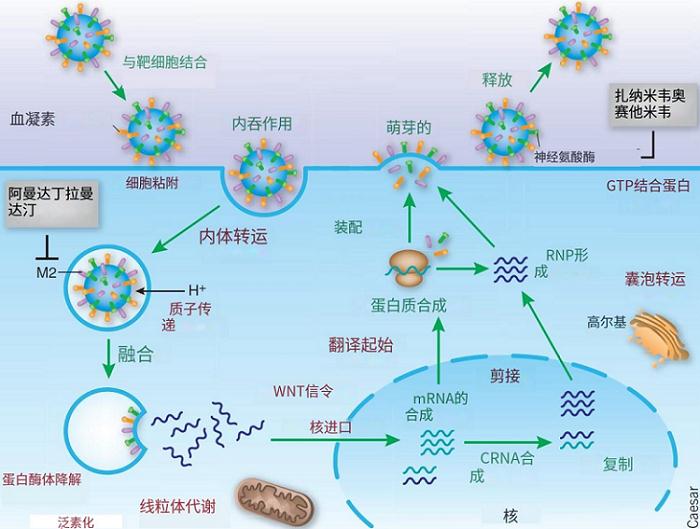
图3.流感病毒复制周期
在流感病毒mRNA合成过程中需要RNA依赖性RNA聚合酶(RdRp酶),RdRp酶由异源三聚体组成,分别为:酸性聚合酶PA亚基及碱性聚合酶PB1、PB2亚基。RNA聚合酶和病毒RNA(及其他成分)共同组成核糖核蛋白(RNP)。
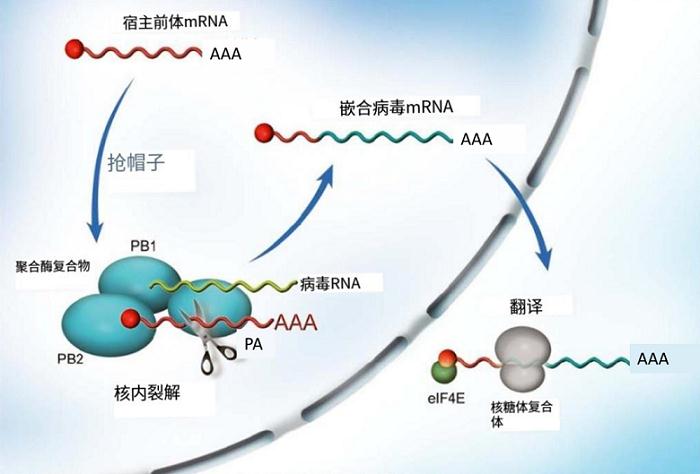
图4.聚合酶PA亚基“抢帽”及剪切组装成完整mRNA
在病毒入侵宿主细胞后,新形成的病毒mRNA并不具备完整功能,需要进行修饰。修饰后具有可供宿主细胞翻译体识别的5'-帽状结构(CAP)、3'-poly(A)尾结构,并进行碱基修饰后方可具有完整转录/翻译功能。
流感病毒本身不能合成/不具有5'-帽状结构。其聚合酶中的PA亚基中的帽依赖性核酸内切酶可识别宿主细胞的前体mRNA,并将宿主前体mRNA中的帽状结构(CAP)剪切掉并“抢来”,拼接到病毒mRNA上,如此一来,病毒mRNA就具有了完整的功能。“抢帽(cap-snatching)”过程为流感病毒转录/翻译起始所必需。
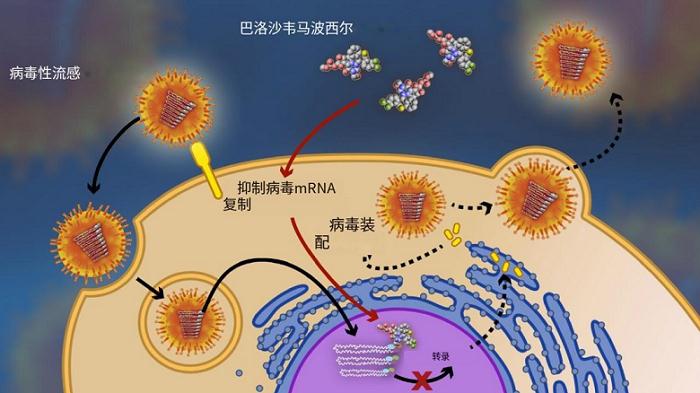
图5.巴洛沙韦作用机制
而巴洛沙韦正是通过抑制帽依赖性核酸内切酶的活性,抑制病毒mRNA的功能化,从而抑制病毒复制增殖。
相比于奥司他韦的抑制病毒“破壳而出”,巴洛沙韦则是抑制病毒mRNA的顺利合成,防止病毒将“作案工具挪为己用”,位于更加上游。
但无论是奥司他韦还是巴洛沙韦,都不具有直接杀死病毒的作用,需等待机体免疫系统清除病毒。
疗效
作为款帽依赖性内切酶抑制剂,巴洛沙韦一直受到广大关注。由于奥司他韦作为一线流感用药已经约20年,因此在数据上直接和奥司他韦比较更具说服力。
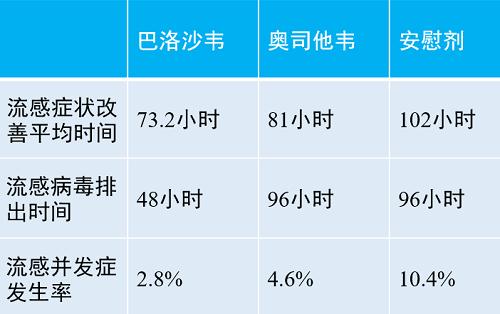
图6.巴洛沙韦治疗高危患者三期临床数据
总体而言,巴洛沙韦的起效速度快于奥司他韦,总体疗效与奥司他韦相当,但安全性优于奥司他韦。
奥司他韦作为流感用药,其霸主地位屹立近20年,疗效、安全性及抗耐药性经得起时间的考验。但巴洛沙韦的的“异军突起”,打乱了流感用药市场奥司他韦一家独大的格局,自巴洛沙韦18年上市后,奥司他韦的市场占有率持续下降,而巴洛沙韦则持续提升。
不过巴洛沙韦虽然目前疗效很好,但是否能扛住病毒耐药性变异的考验,仍需时间来检验。
