背景及概述[1][2]
二硫苏糖醇(DL-Dithiothreitol,简称为DTT)是一种小分子有机还原剂,化学式为C4H10O2S2,主要应用于生物技术领域,作为蛋白质裂解试剂。DTT是一种很强的还原剂,其还原性很大程度上是由于其氧化状态六元环(含二硫键)的构象稳定性。DTT的用途之一是作为巯基化DNA的还原剂和去保护剂。巯基化DNA末端硫原子在溶液中趋向于形成二聚体,特别是在存在氧气的情况下。
这种二聚化大大降低了一些偶联反应实验(如DNA在生物感应器中的固定)的效率;而在DNA溶液中加入DTT,反应一段时间后除去,就可以降低DNA的二聚化。DTT也常常被用于蛋白质中二硫键的还原,可用于阻止蛋白质中的半胱氨酸之间所形成的蛋白质分子内或分子间二硫键。其中,步反应所形成的中间态很不稳定,因为DTT上的第二个巯基趋向于与被氧化的硫原子连接,使中间态很快被转化为DTT的环状氧化结构,从而完成对二硫键的还原。
DTT的还原力受pH值的影响,只在pH值大于7的情况下能够发挥还原作用。这是因为只有脱去质子的硫醇盐负离子才具有反应活性,硫醇则没有;而巯基的pKa一般为8.3。然而该物质长期依赖进口,而且价高昂贵。因此,低成本合成该物质具有一定的市场前景。
目前应用最广泛的DTT合成方法是以苏藓糖醇为原料,先用高锰酸钾氧化,再在硫代乙酸作用下得到硫代中间体,最后水解该硫代中间体得到DTT。该方法的缺陷在于:在生成硫代中间体的同时,会生成一个DTT的同分异构体杂质,该杂质的理化性质和DTT极为相近,从而导致DTT分离提纯困难,产率低,生产成本昂贵,仅适用于实验室合成,不适用于工业化生产。
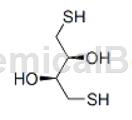
DTT
应用[3]
制备荧光羊毛织物:
(1)溶解液的制备:将30gDTT和2g十二烷基硫酸钠加入到蒸馏水中,形成100g混合溶液,调节pH至8-9,然后加入0.5g长余辉红色发光荧光粉La2O2S:Eu3+纳米粒子,超声振荡下得到分散有长余辉红色发光荧光粉La2O2S:Eu3+纳米粒子的溶解液;
(2)将羊毛织物在步骤(1)所得的溶解液中多次浸轧,轧余率为110%;
(3)将浸轧后的羊毛织物在130℃热风下加热15min;
(4)将加热后的羊毛织物浸渍于乙醇溶液中凝固10min,然后水洗、烘干。
制备 [2]
步骤一:
在500ml圆底烧瓶中依次加入17.9克酒石酸二甲脂,81ml 2,2‑二甲氧基丙烷,8.6克对甲苯磺酸,240ml二氯甲烷,搅拌反应。反应完毕后,减压除去溶剂,加入40ml水,用乙酸乙酯萃取,合并有机相,用无水硫酸镁干燥,减压除去溶剂,得到产品2,3‑O‑异亚丙基酒石酸二甲酯化合物21.1克。收率约99%。
步骤二:
在250ml圆底烧瓶中加入21.1克2,3‑O‑异亚丙基酒石酸二甲酯化合物,加入100ml CH3OH,缓慢加入17克NaBH4,搅拌反应24小时。用乙酸乙酯萃取,合并有机相,用无水MgSO4干燥,除去溶剂得到2,3‑O‑异亚丙基苏醇产品15.6克。收率约98%。
步骤三:
在250ml圆底烧瓶中加入7.8克2,3‑O‑异亚丙基苏醇化合物和60ml THF,缓慢的加入2克NaH,搅拌反应30min后,加入20克p‑TsCl,升温至50℃,反应24小时,用TLC检测反应,待反应完全后,加入饱和NaHCO3溶液,用乙酸乙酯萃取,合并有机相,用H2O洗涤,用无水MgSO4干燥,除去溶剂,得到产品2,3‑O‑异亚丙基苏醇对甲基苯磺酸酯23克。收率约92%。
步骤四:
在100ml圆底烧瓶中加入23克 2,3‑O‑异亚丙基苏醇对甲基苯磺酸酯,15克硫代乙酸钾、25ml乙醇,回流反应12小时,冷却至室温,加入50ml乙醚,过滤,滤液蒸干后加入100ml H2O,用乙醚萃取,用无水MgSO4干燥,除去溶剂, 得到2,3‑O‑异亚丙基二硫苏糖醇二乙酸酯化合物14克,收率约92%。
步骤五:
将14克2,3‑O‑异亚丙基二硫苏糖醇二乙酸加入质量百分比浓度为25%的氢氧化钠溶液,搅拌反应5小时,冷却到室温,用质量百分浓度为2%的盐酸溶液调节PH至7‑8之间,用乙酸乙酯萃取,合并有机层,在常压下蒸掉溶剂,残余浓缩液在真空度为15毫米汞柱,温度为200℃左右条件下进行减压蒸馏,收集130‑140℃之间的馏分,冷却至室温,得到白色固体DTT8.2克。收率约90%。
检测方法
S1、将玻碳电极进行打磨清洗后作为工作电极组成一个三电极体系,并浸入氨基 化石墨烯量子点溶液,通过循环伏安法扫描,在玻碳电极表面电沉积氨基化石墨烯量子点, 所采用的打磨清洗方法为常规物理处理方法,故不再赘述,所组成的三电极体系中的辅助 电极是铂丝电极,参比电极是甘汞电极,氨基化石墨烯量子点溶液的浓度为2mg/mL,采用循 环伏安法对玻碳电极进行扫描的参数设置为:初始电位0V、最高电位1V、最低点位0V、最终 电位0V、扫描速率0.1V/s、扫描次数100次、灵敏度10-4A/V、等待时间为2s,扫描完成后,将修 饰好的玻碳电极置入红外干燥箱中烘干20min,然后取出备用;
S2、配置含有1.0×10-4mol/L邻苯二酚的不同浓度DTT的PBS缓冲溶液,选 用的PBS缓冲溶液的pH值均为7.4,浓度均为0.1mol/L,DTT的浓度分别为0mol/L、 5.0×10-6mol/L、1×10-5mol/L、1.5×10-5mol/L、2×10-5mol/L、2.5×10-5mol/L、5×10- 5mol/L;
S3、将经过步骤一处理的玻碳电极作为工作电极组成和步骤一种相同的三电极体 系,并浸入步骤二中配置的不同浓度DTT的PBS缓冲溶液中,通过循环伏安法测出每 种浓度DTT的PBS缓冲溶液对应的差分脉冲伏安曲线,采用循环伏安法进行扫描的 参数设置为:初始电位-0.4V、最高电位1V、最低点位-0.4V、最终电位-0.4V、扫描速率 0.05V/s、扫描次数2次、灵敏度10-4A/V、等待时间为2s,结果如图1所示,图上曲线从上至下 依次代表浓度分别为0mol/L、5.0×10-6mol/L、1×10-5mol/L、1.5×10-5mol/L、2×10-5mol/ L、2.5×10-5mol/L、5×10-5mol/L的DTT的PBS缓冲溶液在-0.4V~1V的扫描范围内, 电流值的连续变化过程;
S4、从图1中可以观察到反应的电流峰值与随DTT的浓度增大有明显增加, 故取每个浓度的氧化峰电流值,建立DTT浓度与其氧化峰电流值之间的点阵图谱, 如图2所示,并拟合出线性关系表达式:Y=-2.506-0.0299X,R2=0.9994;
S5、取某未知浓度的DTT溶液,加入含1.0×10-4mol/L邻苯二酚的pH值为 7.4的0.1mol/L的PBS缓冲溶液中,然后按步骤三中的方法对含邻苯二酚的未知DTT 浓度的PBS缓冲溶液进行扫描,读出氧化峰电流值,再带入步骤四中的关系式,计算后即可 推导出未知浓度的DTT溶液中DTT的浓度。
主要参考资料
[1] 姜闯道, 高辉远, 邹琦, & 蒋高明. (2003). 二硫苏糖醇处理导致大豆叶片两光系统间激发能分配失衡. 植物生理与分子生物学学报, 29(6), 561-568.
[2] 董改宁, 王新军, 唐量, & 熊正英. (2003). 二硫苏糖醇对小鼠运动耐力、肝组织自由基代谢、肝糖原含量及血清gpt活性影响研究. 陕西师范大学学报(自然科学版), 31(2), 63-66.
[3] 陈新斌, 孙锦, 郭世荣, 陆晓民, 何立中, & 严蓓. (2012). 二硫苏糖醇对海水胁迫下菠菜活性氧代谢及叶绿素荧光特性的影响. 园艺学报, 39(12), 2457-2467.
