背景[1-6]
GPCR筛选与分析服务是针对不同细胞筛选G蛋白偶联受体种类以及基于生化与细胞水平的GPCR功能分析(钙流检测、cAMP检测、报告基因检测、配体-受体结合实验)和药物筛选,包括GPCR激动剂筛选、GPCR拮抗剂筛选、GPCR调节剂、GPCR反向激动剂筛选、靶向药物筛选等。
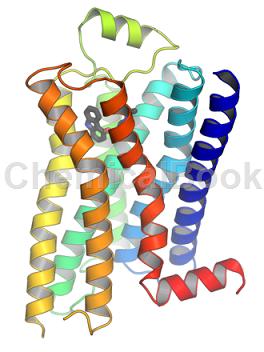
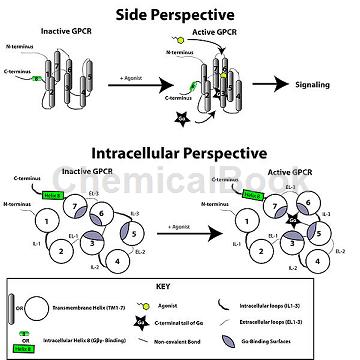
G蛋白偶联受体(G protein-coupled receptor,GPCR)约有800-1000个成员,是生物体内的受体超家族,同时也是重要的药物治疗靶点。G蛋白偶联受体作为重要的细胞信号转导蛋白,当胞外配体与之作用时,其胞内部分与G蛋白结合,激活G蛋白发挥生物学功能。目前约有30-40%的临床药物以GPCRs为作用靶点,治疗疼痛、哮喘、高血压以及免疫系统和神经系统相关疾病。
GPCR超家族的确切大小尚不清楚,但预测至少有810种不同的人类基因(或整个蛋白质编码基因组的约4%)从基因组序列分析中编码。虽然已经提出了许多分类方案,但是超家族经典地分为三个主要类别(A,B和C),在类之间没有可检测的共享序列同源性。迄今为止的一类是A类,占GPCR基因的近85%。A类GPCR的,超过一半的这些预测编码嗅觉受体,而剩余的受体配体的通过已知的内源性化合物或归类为孤儿受体。尽管各类之间缺乏序列同源性,但所有GPCR都具有共同的信号转导结构和机制。
GPCR(G蛋白偶联受体)超家族是人体中最重要的药物靶标。随着计算机技术的发展,越来越多的计算机辅助药物设计方法被用于针对GPCR的药物发现研究,这些方法极大的方便了药物科学家的研究工作。腺苷受体在人体分布广泛,参与了一系列的人体生理过程并涉及了例如神经系统、心血管系统、免疫系统以及癌症的病理过程。腺苷受体表达区域非常广泛,并且很多功能在各亚型之间重叠,因此设计特异性和高选择性的腺苷受体拮抗剂和激动剂具有一定的困难。
视紫红质A组进一步细分为19个亚组(A1-A19)。GPCR包括用于以下配体的一种或多种受体:感觉信号介质(例如,光和嗅觉刺激分子);腺苷,铃蟾肽,缓激肽,内皮素,γ-氨基丁酸(GABA),肝细胞生长因子(HGF),黑皮质素,神经肽Y,阿片肽,视蛋白,生长抑素,GH,速激肽,血管活性肠肽家族成员和加压素;生物胺(例如,多巴胺,肾上腺素,去甲肾上腺素,组胺,血清素和褪黑激素);谷氨酸(代谢型效应);胰高血糖素;乙酰胆碱(毒蕈碱作用);趋化因子;炎症的脂质介质(例如,前列腺素,前列腺素,血小板活化因子和白三烯);肽激素(例如,降钙素,C5a过敏毒素,促卵泡激素[FSH],促性腺激素释放激素[GnRH的],神经激肽,促甲状腺素释放激素[TRH]和催产素);和内源性大麻素。
应用[7][8]
GPCR筛选与分析服务可用于药物受体筛选:
G蛋白偶联受体(G protein-coupled receptors,GPCRs)主要通过激活G蛋白调节下游信号,从而参与某些生理病理反应,而β-arrestin作为细胞内的一种重要骨架蛋白,在绝大部分GPCR介导的信号转导中具有重要调节作用,调控GPCR脱敏、内吞、细胞增殖和基因转录,因此通过研究GPCR与β-arrestin的相互作用来研究GPCR介导的β-arrestin信号通路显得非常必要。
在GPCR信号通路研究模型的建立与应用及孤儿受体的药物筛选实验中通过构建叩头虫荧光素酶(Brazilian Cratomorphus distinctus;Emerald Luc;ELuc)片段分别与AGTR1(β2AR,GCGR)和β-arrestin1/2融合表达质粒,其N端(1-415 aa)与β-arrestin1/2 N端融合(ELucN-β-arrestin1/2),C端(394-542 aa)与AGTR1(β2AR,GCGR)C端融合(AGTR1/β2AR/GCGR-ELucC),瞬转至HEK293细胞中,分别采用Western blot、免疫荧光染色及钙流实验,验证融合表达质粒在HEK293细胞中的表达及其生物学活性。
然后共转AGTR1/β2AR/GCGR-ELucC和ELucN-β-arrestin1/2至HEK293细胞中,通过对细胞转染条件的优化以及化合物刺激时间的研究,检测在配体刺激下AGTR1(β2AR,GCGR)与β-arrestin1/2相互作用情况,并利用该检测模型对已报道的AGTR1、β2AR的偏向性激动剂进行验证。
参考文献
[1]Split-luciferase complementary assay:applications,recent developments,and future perspectives[J].Taha Azad,Amin Tashakor,Saman Hosseinkhani.Analytical and Bioanalytical Chemistry.2014(23)
[2]Advances in the knowledge of light emission by firefly luciferin and oxyluciferin[J].Journal of Photochemistry&Photobiology,B:Biology.2012
[3]SREB2/GPR85,a schizophrenia risk factor,negatively regulates hippocampal adult neurogenesis and neurogenesis‐dependent learning and memory[J].Qian Chen,Jeffrey H.Kogan,Adam K.Gross,Yuan Zhou,Noah M.Walton,Rick Shin,Carrie L.Heusner,Shinichi Miyake,Katsunori Tajinda,Kouichi Tamura,Mitsuyuki Matsumoto.European Journal of Neuroscience.2012(5)
[4]Domain coupling in GPCRs:the engine for induced conformational changes[J].Hamiyet Unal,Sadashiva S.Karnik.Trends in Pharmacological Sciences.2011(2)
[5]Analytical chemiluminescence and bioluminescence:latest achievements and new horizons[J].Aldo Roda,Massimo Guardigli.Analytical and Bioanalytical Chemistry.2012(1)
[6]Relationship between stability and flexibility in the most flexible region of Photinus pyralis luciferase[J].Zahra Amini-Bayat,Saman Hosseinkhani,Rahim Jafari,Khosro Khajeh.BBA-Proteins and Proteomics.2011(2)
[7]Therapeutic potential ofβ-arrestin-and G protein-biased agonists[J].Erin J.Whalen,Sudarshan Rajagopal,Robert J.Lefkowitz.Trends in Molecular Medicine.2010(3)
[8]张建东.GPCR信号通路研究模型的建立与应用及孤儿受体的药物筛选[D].南昌大学,2016.
