背景[1-6]
双荧光素酶报告基因检测是以荧光素(luciferin)为底物来检测萤火虫荧光素酶(fireflyluciferase)活性的一种报告系统。荧光素酶可以催化luciferin氧化成oxyluciferin,在luciferin氧化的过程中,会发出生物荧光(bioluminescence),可通过荧光测定仪设备测定luciferin氧化过程中释放的生物荧光,常应用于启动子转录活性调控及miRNA靶基因验证等方向研究。
双荧光素酶通常是指萤火虫荧光素酶和海肾荧光素。其中荧火虫荧光素是从甲虫(Photinus pyralis)中分离得到,分子量为61kDa;而海肾(Renilla)荧光素酶则是从海肾(Renilla reniformis)中分离,分子量为36kDa。这两种酶的区别之一是他们的底物和辅因子不同:萤火虫荧光素酶需要荧光素、氧气、ATP和镁离子同时存在才能发光;而海肾荧光素酶仅需要腔肠素(coelenterazine)和氧气。萤火虫荧光素酶和海肾荧光素酶的区别之二是发光的颜色不同:萤火虫荧光素酶产生的光颜色呈现黄绿色,波长550-570nm;而海肾荧光素酶产生蓝光,波长480nm。正是由于这两种酶的底物和发光颜色不同,所以在双报告实验中得到广泛应用。
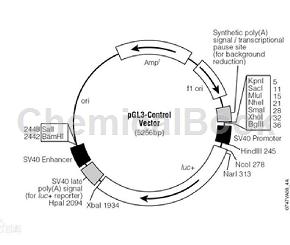
双荧光素酶报告基因检测优势:单报告基因实验往往会受到各种实验条件的影响,而双报告基因则通过共转染的“对照”作为内参为试验提供一基准线,从而可以在程度上减小细胞活性和转染效率等外在因素对实验的影响,使得数据结果更为可信。双荧光素酶报告基因检测常用的载体有两种策略。种是两种荧光素分别位于两个载体上,第二种是两种荧光素酶位于同一个载体上。以种为例,这两种载体分别为pMIR-REPORT miRNA载体和pRL-TK载体。经检索发现,pMIR-REPORT miRNA载体是由Ambion开发的载体,它用来克隆插入miRNA靶序列,评估细胞内miRNA功能的载体。

另外的一个载体是pRL-TK载体,这个载体是由Promega开发的,pRL-TK是海肾荧光素酶报告载体,含有SV40增强子,pMIR-REPORT miRNA这个载体主要是用于评估miRNA与靶基因3’UTR的结合,靶基因的3’UTR放在荧光素酶的后面,这个荧光素酶是荧火虫荧光素酶,而pRL-TK这个载体则表达海肾荧光素酶,将这两个质粒共同转染进入293细胞中来检测荧光时,pRL-TK这个质粒起到一个内参的作用。
应用[7][8]
双荧光素酶报告基因检测可用于癌症药物靶标的验证:
在乳腺癌中miR-155靶标的双荧光素酶报告法验证中microRNA(miRNA)的突变、缺失及表达水平的异常与多种疾病的发生、发展密切相关。miR-155与乳腺癌发生正相关,然而miR-155如何与其靶标mRNA相互作用,进而发挥其在乳腺癌中调控作用的机制尚不十分清楚。因此,寻找miR-155在乳腺癌中靶基因,并以此为主线研究miR-155在某一特定生理或病理过程中的作用是阐述miR-155在乳腺癌中功能所必需的。
挑选在乳腺癌组织和血清中均显著高表达的miR-155,进一步研究其在乳腺癌中的直接调控靶标。使用TargetScan和PicTar两个软件预测miR-155的靶基因,经过三步筛选:(1)两个软件预测的靶基因的交集;(2)根据不同参数,选取保守性和结合动力学等评分较高的的16个靶基因;(3)结合GO(The GeneOntology)、BioGPS(Gene Protal System)、KEGG(Kyoto Encyclopedia of Genes andGenomes)、HPRD(Human Protein Reference Database)和Target miRNA从靶基因的表达特点、位点及功能三方面筛选与乳腺癌相关性大的ACTA1(actin,alpha1,skeletal muscle)和CEBPB(CCAAT/enhancer binding protein,beta)。
将ACTA1和CEBPB的3’UTR(3’untranslated region)全长序列载入到海肾荧光素酶基因的下游,并同时构建结合位点的突变序列,得到pRL-TK-Aw、pRL-TK-Am、pRL-TK-Cw、pRL-TK-Cm四种重组质粒,转染Bcap37乳腺癌细胞,并同时转染miR-155及内参对照萤火虫荧光素酶载体pGL3-control,根据不同转染的海肾荧光素酶表达活性,确定miR-155的靶基因。结果通过SPSS软件分析,结果显示miR-155显著下调CEBPB的3’UTR序列所在的海肾荧光素酶基因(P<0.05);而对ACTA1的3’UTR序列所在的海肾荧光素酶基因活性无明显调控作用(P>0.05)。结论由结果可知,miR-155在乳腺癌中的直接靶基因是CEBPB,miR-155通过下调CEBPB表达量而影响乳腺癌细胞的高增殖指数。
参考文献
[1]Mutations in TPM2 and congenital fibre type disproportion[J].Nigel F.Clarke,Leigh B.Waddell,Lilian T.L.Sie,Bregje W.M.van Bon,Catriona McLean,Damian Clark,Andrew Kornberg,Martin Lammens,Kathryn N.North.Neuromuscular Disorders.2012(11)
[2]MicroRNAs in breast cancer initiation and progression[J].Huiping Liu.Cellular and Molecular Life Sciences.2012(21)
[3]Novel molecular beacons to monitor microRNAs in non-small-cell lung cancer[J].Quan Yao,An-mei Zhang,Hu Ma,Sheng Lin,Xin-xin Wang,Jian-guo Sun,Zheng-tang Chen.Molecular and Cellular Probes.2012(5)
[4]Pre-microRNA binding aminoglycosides and antitumor drugs as inhibitors of Dicer catalyzed microRNA processing[J].Mohitosh Maiti,Koen Nauwelaerts,Piet Herdewijn.Bioorganic&Medicinal Chemistry Letters.2011(4)
[5]Identification of novel transcripts deregulated in buccal cancer by RNA-seq[J].Manisha R.Sajnani,Amrutlal K.Patel,Vaibhav D.Bhatt,Ajai K.Tripathi,Viral B.Ahir,Vangipuram Shankar,Siddharth Shah,Tejas M.Shah,Prakash G.Koringa,Subhash J.Jakhesara,Chaitanya G.Joshi.Gene.2012(2)
[6]Clinical significance of miR-155 expression in breast cancer and effectsof miR-155 ASO on cell viability and apoptosis[J].Shu-Rong Zheng,Gui-Long Guo,Wei Zhang,Guan-Li Huang,Xiao-Qu Hu,Jin Zhu,Qi-Di Huang,Jie You,Xiao-Hua Zhang.Oncology Reports.2012(4)
[7]Expression of miR-146a and miR-155 in the urinary sediment of systemic lupus erythematosus[J].Gang Wang,Lai-Shan Tam,Bonnie Kwan,Edmund Li,Kai-Ming Chow,Cathy Luk,Philip Li,Cheuk-Chun Szeto.Clinical Rheumatology.2012(3)
[8]孟丽.乳腺癌中miR-155靶标的双荧光素酶报告法验证[D].浙江理工大学,2013.
