背景及概述[1]
上皮细胞覆盖于身体表面并衬贴于体内空腔器官腔面的细胞。其排列有明显极性,一面朝向身体表面或腔面,称游离面;一面向着深部的结缔组织,称基底面。上皮细胞具有强大的角生和更新能力。上皮组织具有保护、吸收、分泌和排泄等作用。当上皮细胞受损时,则影响机体的防御功能。小鼠气管上皮细胞分离自气管组织;气管上皮是气道与外界环境接触的道防线,不仅是各种病原体、炎症介质作用的靶细胞,还作为效应细胞合成、释放多种炎性介质和细胞因子从而参与气道炎症及免疫反应。体外培养的原代小鼠气管上皮细胞因与体内组织在形态结构和功能活动上存在很大的相似性,因此,在基础及临床研究中极为重要。
细胞的分离和气液相界面培养[2]
健康雌、雄性小鼠,7~8周龄,体重18~22g/只。将小鼠予以颈椎脱臼处死,75%酒精浸泡消毒,仰卧位固定,无菌条件下游离气管至支气管分叉处,取出气管,放入含100u/ml青霉素和100μg/ml的链霉素的冷PBS中分离去除气管旁的结缔组织,用PBS清洗两次,去除血污和组织碎片,将气管纵形剖开,放入含0.1%蛋白酶的离心管中4℃消化过夜。然后加入胎牛血清至终浓度为10%终止消化,反复颠倒离心管12次,将气管移至另一含有10%FBS的DMEM/F12培养基的离心管中,再次反复颠倒离心管12次,充分分离和释放细胞。丢弃气管,将两管细胞悬液收集到一起,1000r/min离心5min,弃上清,加含有双抗的DMEM/F12培养基5ml,充分吹匀细胞,1000r/min离心5min,清洗细胞3次,以去除残留的蛋白酶。
将细胞重悬于含有10%FBS的DMEM/F12培养基中,种入细胞培养板中,于37℃、5%CO2培养箱中孵育2~3h,去除成纤维细胞。将未贴壁的细胞收集起来,1000r/min离心5min,以含有5%FBS小鼠气管生长培养基重悬细胞,用0.4%的台盼蓝排除法鉴定细胞活力,细胞存活率达90%以上。调整细胞密度后,以7.5×104/cm2细胞密度接种至预先铺有胎盘胶原的millicell小室中,同时下室也加入含有5%FBS小鼠气管生长培养基入37℃、5%CO2培养箱中培养24h。24h后更换为无血清的小鼠气管生长培养基继续培养。每隔2d换液1次,直到用Millicell-ERS阻力系统测细胞跨膜压差>1000Ψ·cm2。去掉上室的培养基,建立气液相界面培养[2-3],下室继续加小鼠气管生长培养基培养,每隔2d换液1次。气液相界面培养第10~15天的细胞用于实验。
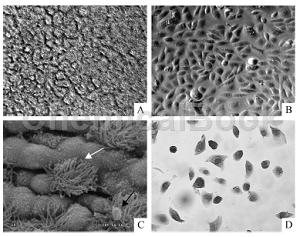
结果:首先在倒置显微镜下观察小鼠气管上皮细胞的生长状态和形态学变化。在Millicell小室内,以含有5%FBS小鼠气管上皮生长培养基接种气管上皮细胞24h后,细胞贴壁率约为40%,24h后更换无血清气管上皮生长培养基,细胞体积增大,并进入分裂相,72h后细胞增殖旺盛。大约7~10d细胞用Millicell-ERS阻力系统测细胞跨膜压差>1000Ψ·cm2,提示细胞生长融合,去掉Millicell上室的培养基,建立气液相界面培养。倒置显微镜下观察生长在半渗透膜上的细胞,见细胞呈重叠生长,上层为较大的圆形细胞,下层为较小的圆形细胞(图1A)。在预先铺有胶原的塑料培养板中,无血清培养的气管上皮细胞呈单层生长,为多角形,相嵌状,镜下见细胞连接成片,呈铺路石样改变(图1B)。气液相界面培养第15天扫描电镜下可见部分细胞细胞一侧上有纤毛长出,多呈分散或成簇状分布,具有纤毛柱状上皮细胞的特征。此外,可见细胞表面有黏液糖蛋白的附着(图1C)。用抗鼠的pancytokeratin抗体进行细胞免疫组化鉴定,实验步骤同前,可见大部分细胞胞浆呈棕色阳性染色(图1D)。
相关研究[3]
有研究探讨重组甲型流感病毒基质蛋白1和2(rM1和rM2)通过细胞外信号调节蛋白激酶(Extracellularsignalregulatedkinase,ERK)诱导小鼠气管上皮细胞产生γ-干扰素(Interferon-γ,IFN-γ)作用及机制。以原代小鼠气管上皮细胞为实验模型,实验分为6组(rM1组、rM2组、甲型流感病毒(InfluenzaAvirus,IAV)组、rM1+IAV组、rM2+IAV组和正常对照组)。在各组分干预细胞4h、8h、24h时,采用半定量RT-PCR法检测各组细胞中IFN-γmRNA的表达和免疫印迹法检测各组细胞中IFN-γ、ERK、磷酸化ERK(phospho-ERK,p-ERK)蛋白的表达;用抑制剂阻断ERK信号因子信号传导,观察对各组分诱导小鼠气管上皮细胞产生IFN-γ的影响。各组分干预细胞4h、8h、24h,rM1组、rM2组、IAV组、rM1+IAV组、rM2+IAV组细胞的IFN-γmRNA和IFN-γ蛋白表达水平高于正常对照组(P<0.01或P<0.05);rM1+IAV组、rM2+IAV组细胞的IFN-γmRNA和IFN-γ蛋白表达水平高于IAV组(P<0.01或P<0.05)。在干预细胞4h,仅rM2组细胞中ERK磷酸化水平显著高于正常对照组(P<0.01),在干预细胞8h、24h,rM1组、rM2组、IAV组、rM1+IAV组、rM2+IAV组细胞中ERK磷酸化水平均显著高于正常对照组(P<0.01或P<0.05)。加入ERK抑制剂,rM1组、rM2组、rM1+IAV组、rM2+IAV组细胞的IFN-γmRNA和IFN-γ蛋白表达水平显著低于非抑制剂组。本研究数据表明rM1和rM2可通过上调ERK信号因子的磷酸化水平诱导小鼠气管上皮细胞中产生IFN-γ,该诱导作用在干预4h即显著表现,并维持至少24h。
主要参考资料
[1] 儿科学辞典
[2] 小鼠气管上皮细胞的气液相界面培养
[3] 重组甲型流感病毒基质蛋白1和2通过ERK信号因子诱导小鼠气管上皮细胞产生IFN-γ
