背景[1-6]
大鼠血清采用健康大鼠血液为原料,经无菌采集、分离、微孔过滤后而成,性状为澄清液体,无噬菌体、超低内毒素,无溶血无异物无细菌真菌支原体霉形体衣原体等,适用于试验室或生化科研相关试验,满足不同科研实验的多种需求。
大鼠血清来源于非免疫的大鼠宿主,经过脂质萃取和含NaN3的PBS溶液透析,改善其透明度。推荐用PBS将封闭血清原液稀释5-20倍,配成5%-20%的工作液,直接滴加在组织切片或者细胞涂片上,37℃度孵育10-30分钟,清除血清,勿洗,滴加适当比例稀释的一抗工作液,37℃孵育1-2h或4℃过夜。注意:封闭用血清中不能含有目标蛋白,且与一抗来源不同,可用与二抗相同来源的封闭血清。

大鼠采血方式:
1、剪尾采血:需血量较少时常用此法。先将动物固定,将鼠尾浸在50℃左右温水中浸泡几分钟或用酒精棉球或二甲苯涂擦鼠尾,使尾部血管充盈,剪去尾尖1~2mm(小鼠)或3~5mm(大鼠),便血液顺血管壁自由流入试管或用血红蛋白吸管吸取。采血结束时,伤口消毒并用棉球压迫止血。此法每只鼠一般可采血10次以上,小鼠每次可取血0.1mL左右,大鼠可取血0.3~0.5ml。
2、眶后静脉丛采血:操作者一手固定小鼠或大鼠,拇指和食指尽量将鼠头部皮肤捏紧,或轻轻压迫颈部两侧,使鼠眼球突出,眶后静脉丛充血,另一只手持毛细采血管,以45°从内眼角刺入,并向下旋转,感觉刺入静脉丛后,再向外边退边吸,当得到所需血量后,放松加于颈部的压力,并拔出采血器,以防穿刺孔出血。若技术熟练,此方法在短斯内可重复采血,小鼠一次可采血0.2~0.3ml,大鼠可采血约0.5ml。如只进行一次取血,可采用摘眼球法,右手取一眼科弯镊,在鼠右或左侧眼球根部将眼球摘去,并将鼠倒置;头向下,抽取血液。
大鼠血清是细胞培养中用量的天然培养基,含有丰富的细胞生长必须的营养成份,常用于动物细胞的体外培养,具有极为重要的功能。优点:血清中含有许多对细胞生长有利的成分,提供丰富的营养物质,促进细胞生长。缺点:血清的具体成分不明确,不容易控制变量;血清的保存期短,血清中可能含有易变物质;血清中可能含有病毒等生物,对实验结果造成不良影响;使用血清成本较高。
1.提供维持细胞指数生长的激素,基础培养基中没有或量很少的营养物,以及主要的低分子营养物。
2.提供结合蛋白,能识别维生素、脂类、金属和其他激素等,能结合或调变它们所结合的物质活力。
3.有些情况下结合蛋白质能与有毒金属和热原质结合,起到解毒作用。
4.是细胞贴壁、铺展在塑料培养基质上所需因子来源。
5.起酸碱度缓冲液作用。
6.提供蛋白酶抑制剂,使在细胞传代时使剩余胰蛋白酶失活,保护细胞不受伤害。
应用[7][8]
大鼠血清主要用于原代细胞培养、传代细胞培养及病毒疫苗的研制和生产。
在大鼠大脑皮质神经元原代培养不同培养体系及纯化方法的比较研究实验中比较两种大鼠大脑皮质神经元的培养及纯化方法不同组合的优劣,探讨科学可靠的神经元培养纯化方法。
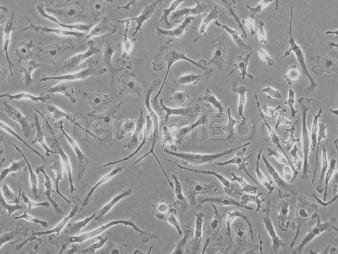
方法:采用DMEM/F12+血清的有血清培养体系和神经基础培养基(Neurobasal)+B27的无血清培养体系培养原代神经元。在接种3天后分别采用加入阿糖胞苷和5-氟脱氧尿嘧啶两种方法进行神经元的纯化。在1天、3天、7天采用形态学及7天时免疫荧光化学法鉴定神经元的纯度及生长状态。结果:1天、3天时,有血清培养体系和无血清体系中的神经元的形态结构和密度无明显差别,在分别加入阿糖胞苷和5-氟脱氧尿嘧啶后,7天时无血清体系中加阿糖胞苷组细胞密度明显低于其他三组细胞密度。通过免疫荧光化学法鉴定可见无血清体系中的神经元纯度明显高于有血清体系。
结论:有血清体系的神经元纯度较差,阿糖胞苷和5-氟脱氧尿嘧啶不能显著抑制胶质细胞等杂细胞的生长。无血清培养体系加阿糖胞苷的神经元细胞受损较多,无血清培养体系加5-氟脱氧尿嘧啶纯化培养的大鼠大脑皮质神经元,纯度较高,细胞数量合适,是体外研究神经系统相关理论的良好模型。
参考文献
[1]Optimized survival of hippocampal neurons in B27-supplemented Neurobasal,a new serum-free medium combination.Brewer GJ,Torricelli JR,Evege EK,et al.Journal de Neuroradiologie.1993
[2]Cytoskeletal immunohistochemistry of central neurocytomas.Hessler R B,Lopes M B S,Frankfurter A,et al.American J Surgical Pathology.1992
[3]Insulin Receptor-Protein Kinase C-Sig-naling Mediates Inhibition of Hypoxia-In-duced Necrosis of Cortical Neurons.Hamabe W,Fujita R,and Ueda Hetal.Journal of Pharmacology and Experimental Therapeutics.2005
[4]Influence of ser-um-free mediumon the expression of glutamate transporters and the sus-ceptibility to glutamate toxicity in cultured cortical neurons.Velasco I,Velasco-Velazquez MA,Salazar P,et al.Journal of Neuroscience Research.2003
[5]Are-liable method for culture of dissociated mouse cerebellar cells enriched for Purkinje neurons.Tabata T,Sawada S,Araki Ket al.Journal of Neuroscience Methods.2000
[6]Modulation of Microtubule Dynamic Instability in vivo by Brain Microtubule Associated Proteins.Dhamodharan,R.,Wadsworth,P.Journal of Cell Science.1995
[7]Roles of collagenases and other proteolytic enzymes in the dispersal of animal tissues.Kono T.Biochimica et Biophysica Acta.1969
[8]张玮,唐卉凌,王筠,李卫红,侯金才,曹进,李澎涛.大鼠大脑皮质神经元原代培养不同培养体系及纯化方法的比较研究[J].现代生物医学进展,2010,10(06):1043-1046.
