背景[1-7]
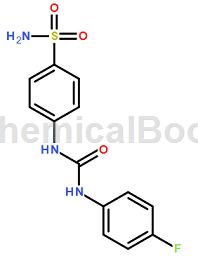
U-104(Carbonic Anhydrase抑制剂)是一种有效的碳酸酐酶(CA)抑制剂,作用于CA IX和CA XII,Ki分别为45.1nM和4.5nM,对CA I和CA II抑制活性弱。4T1细胞缺氧条件下U-104(50μM)会阻断癌症干细胞群的间质表型。U-104(<50μM)显著减少转移性MDA-MB-231 LM2-4Luc+细胞的迁移并具有剂量依赖特性,同时细胞生长成类似于亲本MDA-MB-231细胞的紧密型克隆。U-104在第二氮脲基处具有芳香基团。
U-104(38mg/kg)抑制植入MDA-MB-231 LM2-4Luc+细胞的小鼠中原代肿瘤的生长。在4T1实验用转移小鼠模型中U-104(19mg/kg)可抑制转移形成。在植入MDA-MB-231 LM2-4Luc+细胞的NOD/SCID小鼠模型中,U-104(38mg/kg)显著延缓原代肿瘤生长并减少癌症干细胞数量。U-104(5mg/ml,填喂给药)处理后显著延缓植入4T1细胞的Balb/c小鼠中肿瘤生长速度。
碳酸酐酶(Carbonic anhydrases,CAs)是广泛存在于动、植物和微生物中的一类含锌金属酶,主要功能为催化二氧化碳的可逆水合反应,对机体内气体交换、离子交换以及维持细胞内外pH值平衡等有重要影响。CA抑制剂(CAIs)作为药物具有广泛的临床应用。以CA为靶点,围绕抗肿瘤和抗青光眼两个方向,开展基于靶点结构的新颖小分子抑制剂的设计、合成及活性评价研究。采用糖基结构修饰经典CA抑制剂的方法是发现新颖CA抑制剂的有效策略之一。
碳酸酐酶(CarbonicAnhydrase,CAs,EC4.2.1.1)是一类含Zn2+的金属酶,能够高效可逆地催化C02水合反应,并且在人体的生理、病理等方面都发挥着重要的作用。其中,碳酸酐酶Ⅱ(CAⅡ)是催化C02水合效率最高,同时也是研究最为透彻的一类碳酸酐酶。它在生物体内的功能与其结构及结构转换密切相关。因此,研究HCAⅡ对加深与碳酸酐酶相关的生物学过程和疾病形成原因的认识与理解具有十分重要的意义。
应用[8][9]
U-104(Carbonic Anhydrase抑制剂)可用于对氧肿瘤细胞增殖抑制的研究:
碳酐酶IX(Carbonic AnhydraseⅨ,CAⅨ)是α-碳酐酶(α-CAs)家族中与肿瘤乏氧相关的一个亚型,它是许多肿瘤不良预后的标志物,也是治疗乏氧肿瘤的重要的药物作用靶标。以人类的CAⅨ为靶标,首先采用基于结构的虚拟筛选方法,从SPECS商业数据库中筛选出51个候选化合物。然后,通过测试CAⅨ阳性抑制剂AZA和EZA的抑制活性,验证了以CO2饱和水溶液为底物,以酚红为指示剂,利用停流光谱仪(Stopped Flow Instrument)进行CAⅨ抑制剂筛选方法的有效性,并对上述51个化合物进行了分子水平的活性筛选。
结果发现,15个化合物表现出良好的CAⅨ抑制活性。其中,化合物1,2,3和4的抑制活性与阳性抑制剂乙酰唑胺(AZA),依索唑胺(EZA)相当。我们还测定了这15个化合物对与肿瘤不相关的CAⅠ、CAⅡ的抑制活性,结果表明,相对于CAⅠ、CAⅡ,化合物1,2,3和10对CA IX的抑制效果更好,表现出较好的CAⅨ选择性。
通过MTT实验,我们测定出化合物7和11对乏氧培养后乳腺癌细胞MDA-MB-231的增殖有抑制效果。另外,通过对阳性抑制剂AZA和EZA抑制活性的测试,验证了以酶标仪进行CAⅠ和CAⅡ抑制剂筛选的可行性。该方法具有高效、便捷、成本低等特点。
参考文献
[1]Synthesis and crystallographic analysis of new sulfonamides incorporating NO-donating moieties with potent antiglaucoma action[J].Francesco Mincione,Francesca Benedini,Stefano Biondi,Alessandro Cecchi,Claudia Temperini,Giuseppe Formicola,Ilaria Pacileo,Andrea Scozzafava,Emanuela Masini,Claudiu T.Supuran.Bioorganic&Medicinal Chemistry Letters.2011(11)
[2]Sulfonamides incorporating boroxazolidone moieties are potent inhibitors of the transmembrane,tumor-associated carbonic anhydrase isoforms IX and XII[J].Marouan Rami,Alfonso Maresca,Fatma-Zhora Smaine,Jean-Louis Montero,Andrea Scozzafava,Jean-Yves Winum,Claudiu T.Supuran.Bioorganic&Medicinal Chemistry Letters.2011(10)
[3]Virtual screening-driven identification of human carbonic anhydrase inhibitors incorporating an original,new pharmacophore[J].Nicolino Pala,Roberto Dallocchio,Alessandro Dessì,Andrea Brancale,Fabrizio Carta,Simone Ihm,Alfonso Maresca,Mario Sechi,Claudiu T.Supuran.Bioorganic&Medicinal Chemistry Letters.2011(8)
[4]Pteridine–sulfonamide conjugates as dual inhibitors of carbonic anhydrases and dihydrofolate reductase with potential antitumor activity[J].Sérgio M.Marques,éva A.Enyedy,Claudiu T.Supuran,Natalia I.Krupenko,Sergey A.Krupenko,M.Amélia Santos.Bioorganic&Medicinal Chemistry.2010(14)
[5]Coumarinyl-substituted sulfonamides strongly inhibit several human carbonic anhydrase isoforms:solution and crystallographic investigations[J].Jason Wagner,Balendu Sankara Avvaru,Arthur H.Robbins,Andrea Scozzafava,Claudiu T.Supuran,Robert McKenna.Bioorganic&Medicinal Chemistry.2010(14)
[6]NO-releasing esters show carbonic anhydrase inhibitory action against human isoforms I and II[J].Bioorganic&Medicinal Chemistry.2010(10)
[7]Nanoscale enzyme inhibitors:Fullerenes inhibit carbonic anhydrase by occluding the active site entrance[J].Alessio Innocenti,Serdar Durdagi,Nadjmeh Doostdar,T.Amanda Strom,Andrew R.Barron,Claudiu T.Supuran.Bioorganic&Medicinal Chemistry.2010(8)
[8]Carbonic anhydrase inhibitors.Inhibition of mammalian isoforms I–XIV with a series of natural product polyphenols and phenolic acids[J].Bioorganic&Medicinal Chemistry.2010(6)
[9]杨春梅.碳酐酶IX抑制剂的筛选及其对乏氧肿瘤细胞增殖抑制的研究[D].华东理工大学,2012.
