背景[1-6]
ChIP-qPCR检测服务可用于研究已知基因组结合位点处的蛋白质-DNA相互作用。如果位点未知,qPCR引物也可以针对潜在的调控区域(例如启动子)进行设计。ChIP-qPCR在关注特定基因和潜在调控区域的研究中具有优势,因为qPCR的成本极低,可以在不同的实验条件下进行。该技术现在用于各种生命科学学科,包括细胞分化,肿瘤抑制基因沉默以及组蛋白修饰对基因表达的影响等。
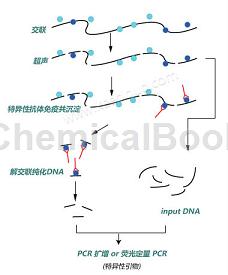
Chromatin Immnoprecipitation(ChIP)是研究体内DNA与蛋白质相互作用的一种技术。它在活细胞状态下固定蛋白质-DNA复合物,并将其随机切断为一定长度范围内的染色质小片段,然后利用抗原抗体反应的特异性,特异性地富集目的蛋白结合的DNA片段,通过对目的片段的纯化与检测分析,获得蛋白质与DNA相互作用的信息。可以真实地反映体内蛋白因子与基因组DNA结合的状况,当需要了解某特异的DNA结合蛋白所结合的DNA序列时,该技术是*好的方法;还可以对基因组中的组蛋白修饰进行分析定位,从而研究组蛋白的各种共价修饰与基因转录调控的关系。
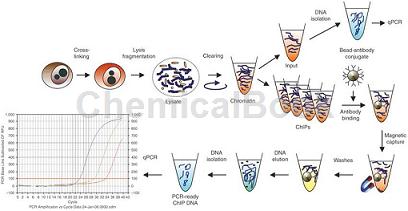
ChIP-qPCR是利用荧光实时定量PCR检测ChIP样品的常用手段。ChIP-qPCR技术实现了在靶基因的启动子上找到转录因子结合的直接证据,是细胞内真实的、原位的结果,同时可以比较与不同位点的结合能力的比较,相对于EMSA、luciferase报告载体等体外实验验证更具说服力。
实验原理:
甲醛使DNA与其结合蛋白交联,通过超声波或酶处理,使染色质断裂为小片段,加入特定抗体,对目的基因进行标记,免疫沉淀得到靶片段,解交联得到基因片段,获得的基因片段可用于后续PCR分析。
检测流程
染色质准备→染色质剪切→染色质免疫沉淀→DNA纯化→qPCR
ChIP是一种在活体内研究DNA和蛋白质相互作用的方法,广泛用于多领域中染色质相关蛋白的研究。相比其他DNA与蛋白相互作用的研究方法,ChIP的突出优势在于通过检测蛋白与DNA的结合,研究体内真实情况下的染色质结构,从而得出确凿的诱导或阻碍转录的证据,这对构架信号调控网络至关重要。
ChIP-Qpcr/PCR技术采用特定抗体来富集存在组蛋白修饰或转录调控具有直接作用的DNA片段。通过选择自己感兴趣的目的基因,设计特异性的引物,对特异性抗体(并设置相应的阳性对照和阴性对照和Input)免疫共沉淀后纯化出的DNA片段进行PCR或qPCR进行验证,高重复地半定量或定量生物样品中特定转录因子/组蛋白修饰与已知基因启动子的结合。
应用[7][8]
ChIP-qPCR检测服务可用于肿瘤恶性行为的表观遗传分子机制研究:
MicroRNAs(miRNAs)是一类长度为21-25个核苷酸的非编码单链小分子RNA,可以通过特异性地识别和结合3’-UTR区的互补序列,降解或抑制mRNA的翻译来抑制靶基因的表达。它们广泛参与了细胞分化、增殖、凋亡、组织器官发育等生理过程,也是肿瘤恶性行为的重要调控因子。因为miRNA在进化上的保守性和在细胞内作用的广泛性,在各种肿瘤细胞中表达异常的miRNA,尤其是广泛下调的抑癌性miRNA一直被认为是激活癌基因、促进肿瘤发生发展的重要影响因子。
Wnt信号作为影响细胞生长发育的关键性通路,已被证实在很多肿瘤中异常表达,其中最常见的便是结肠癌。经典的Wnt信号由细胞内抑癌基因APC的突变移除或致癌基因β-catenin的激活启动,继而通过β-catenin在细胞核内的聚积及其与转录因子TCF4的结合激活下游基因c-Myc和CCND1等的转录。除这一经典的转录激活作用外,不少研究也证实了TCF4单独或与β-catenin一起对Wnt通路下游基因的转录抑制作用。
在这些受调控的基因中,近期研究报道了miRNA作为转录后调控因子,也分布在Wnt通路的调控网络中。通过分析TCF4在HCT116细胞中的ChIP-seq数据库、干扰内源性TCF4表达以及对候选miRNA启动子区的ChIP-qPCR检测,确定要研究的被Wnt信号调控的miRNA;在激活和抑制Wnt信号的情况下,用qPCR检测该miRNA的表达以确定调控关系;通过ChIP-qPCR检测该miRNA启动子区是否有Wnt信号核心转录复合物TCF4-β-catenin的结合富集。
参考文献
[1]MicroRNAs:Potential candidates for diagnosis and treatment of colorectal cancer[J].Abdullah Moridikia,Hamed Mirzaei,Amirhossein Sahebkar,Jafar Salimian.Journal of Cellular Physiology.2018(2)
[2]MicroRNAs in the etiology of colorectal cancer:pathways and clinical implications[J].Ashlee M.Strubberg,Blair B.Madison.Disease Models&Mechanisms.2017(3)
[3]Evaluation and identification of factors related to KRAS and BRAF gene mutations in colorectal cancer:A meta-analysis[J].Li Lin,Guang-yong Chen,Chun-wei Xu,Hai-yan Wang,Yong-fang Wu,Mei-yu Fang.Journal of Cancer Research and Therapeutics.2016(7)
[4]Blood-based biomarkers for diagnosis,prognosis and treatment of colorectal cancer[J].Ebru E.Y?rüker,Stefan Holdenrieder,Ugur Gezer.Clinica Chimica Acta.2016
[5]MicroRNA-155 enhances the activation of Wnt/β-catenin signaling in colorectalcarcinoma by suppressing HMG-box transcription factor 1[J].Ying?Chun Wan,Tao Li,Yang?Dong Han,Hai?Yan Zhang,Hai Lin,Bin Zhang.Molecular Medicine Reports.2016(3)
[6]Matters of context guide future research in TGFβsuperfamily signaling[J].Rosemary J.Akhurst,Richard W.Padgett.Science Signaling.2015(399)
[7]A feedback regulation between miR-145 and DNA methyltransferase 3b in prostate cancer cell and their responses to irradiation[J].Gang Xue,Zhenxin Ren,Yaxiong Chen,Jiayun Zhu,Yarong Du,Dong Pan,Xiaoman Li,Burong Hu.Cancer Letters.2015(1)
[8]王微.Wnt信号调控结肠癌恶性行为的表观遗传分子机制[D].中国人民解放军空军军医大学,2018.
