背景[1-6]
小鼠原代食管成纤维细胞位于上段、下端食道的固有层,是来源于胚胎中胚层的间充质细胞。成纤维细胞分泌非刚性细胞外基质,该基质富含I型和III型胶原蛋白。它们负责结蹄组织中细胞外基质的大量分泌,并在伤口愈合中起到了重要作用。由于成纤维细胞是最容易培养的细胞类型之一,故它们广泛用于大量细胞学和分子学研究。原代细胞是指来源于胚胎、组织器官及外周血,经特殊分离方法制备而得的原初培养的细胞。
常用的原代细胞的培养方式有组织块培养和分散细胞培养。组织块培养是将剪碎的组织块直接移植在培养瓶壁上,加入培养基后进行培养;分散细胞培养则是将组织块用机械法或化学法使细胞分散。如欲从胎儿或新生儿的组织分离到活性的游离细胞,经典的方法是用蛋白水解酶(如胰蛋白酶和胶原酶)消化细胞间的结合物,或用金属离子螯合剂(如EDTA)除去细胞互相粘着所依赖的Ca2+,再经机械轻度振荡使之成为单细胞,再加入合适的培养基进行培养,使细胞得以生存、生长和繁殖。

通过培养原代细胞系,能够准确模拟生物体内的状态,并获得与正常生理功能更加相关的数据。因此,原代细胞不仅广泛应用于分子、细胞生物学和生物医学基础研究,如蛋白质组学、基因组学、细胞株(系)研究及遗传学研究等,还可应用于生物医药产业如药物筛选、药物代谢和毒理研究、癌症药物研究等。
细胞特性:
1)组织来源于实验动物的正常食管组织。
2)细胞鉴定:纤维连接蛋白(Fibronectin)或波形蛋白(Vimentin)免疫荧光染色为阳性。
3)经鉴定细胞纯度高于90%。
4)不含有HIV-1、HBV、HCV、支原体、细菌、酵母和真菌。
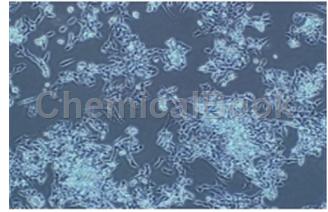
5)细胞生长方式:长梭形细胞,不规则细胞,贴壁培养。
应用[7][8]
小鼠原代食管成纤维细胞可用于间质成纤维细胞在食管癌变进程中作用及机制的研究:
活化的癌相关纤维母细胞(Cancer-associated fibroblasts CAFs)是肿瘤间质微环境内的主要效应细胞,研究证实,包括食管癌在内的多种肿瘤组织内的癌相关纤维母细胞,与正常成纤维细胞相比,在形态结构、生长方式、增殖活性、运动能力等发面均发生了显著变化,并且能够分泌大量的促进肿瘤细胞增殖、血管新生的信号分子以介导上皮-间质之间复杂的相互作用。
目的:食管癌的发展是一个渐进的过程,从正常鳞状上皮发展到鳞状细胞癌的过程中存在中间过渡阶段—不典型增生鳞状上皮或异型增生鳞状上皮,此种上皮与正常鳞状上皮和癌上皮细胞有着不同的结构与功能,在癌前病变间质组织中,是否也存在正常成纤维细胞向癌相关纤维母细胞转化的过渡阶段-不典型增生间质成纤维细胞尚不知晓,与正常成纤维细胞和癌相关纤维母细胞相比,其结构和功能特性又会有何不同,在食管癌变进展中起到何种作用,具体作用机制如何,均有待研究证实。
食管间质成纤维细胞在食管癌变进程中扮演何种角色,深入研究其具体作用机制可能有助于食管癌及食管癌前病变的早期诊断,早期治疗,为食管癌及食管癌前病变的药物治疗提供作用靶点。在食管癌变进程中,食管正常间质成纤维细胞与癌相关纤维母细胞间存在中间过渡阶段-食管不典型增生成纤维细胞。从正常成纤维细胞→不典型增生成纤维细胞→癌相关纤维母细胞,其免疫表型逐步发生了改变。
体外可成功培养三种食管间质成纤维细胞。从正常成纤维细胞→不典型增生成纤维细胞→癌相关纤维母细胞,细胞功能越发活跃,生物学特性发生了改变,处于增殖期细胞比例增高。癌细胞可通过旁分泌细胞因子,间接刺激食管间质成纤维细胞,使其功能发生改变。食管间质成纤维细胞亦可通过旁分泌细胞因子,间接刺激癌细胞的增殖,同时可增强癌细胞的侵袭力。动物模型显示:正常食管间质成纤维细胞在与癌细胞直接接触后,可使其表型向癌相关纤维母细胞发生转化。活化的食管间质成纤维细胞在与癌细胞直接接触后,可加速肿瘤的生长。
参考文献
[1]Cancer-associated fibroblasts and tumor growth–bystanders turning into key players[J].Current Opinion in Genetics&Development.2009(1)
[2]TGF-β-induced fibroblast activation protein expression,fibroblast activation protein expression increases the proliferation,adhesion,and migration of HO-8910PM[J].He Chen,Wei-Wei Yang,Qiu-Ting Wen,Li Xu,Ming Chen.Experimental and Molecular Pathology.2009(3)
[3]Overexpression and Interactions of Interleukin-10,Transforming Growth Factorβ,and Vascular Endothelial Growth Factor in Esophageal Squamous Cell Carcinoma[J].Mehran Gholamin,Omeed Moaven,Bahram Memar,Moein Farshchian,Hossein Naseh,Reza Malekzadeh,Masoud Sotoudeh,Mohammad Taghi Rajabi-Mashhadi,Mohammad Naser Forghani,Farid Farrokhi,Mohammad Reza Abbaszadegan.World Journal of Surgery.2009(7)
[4]The basics of epithelial-mesenchymal transition[J].Kalluri,Raghu,Weinberg,Robert A.Journal of Clinical Investigation.2009(6)
[5]A Perivascular Origin for Mesenchymal Stem Cells in Multiple Human Organs[J].Cell Stem Cell.2008(3)
[6]Co-evolution of tumor cells and their microenvironment[J].Kornelia Polyak,Izhak Haviv,Ian G.Campbell.Trends in Genetics.2008(1)
[7]Stromal Fibroblasts Present in Invasive Human Breast Carcinomas Promote Tumor Growth and Angiogenesis through Elevated SDF-1/CXCL12 Secretion[J].Akira Orimo,Piyush B.Gupta,Dennis C.Sgroi,Fernando Arenzana-Seisdedos,Thierry Delaunay,Rizwan Naeem,Vincent J.Carey,Andrea L.Richardson,Robert A.Weinberg.Cell.2005(3)
[8]徐志彬.间质成纤维细胞在食管癌变进程中作用及机制的研究[D].河北医科大学,2014.
