背景[1-6]
人关节滑膜成纤维细胞源于手术取得人正常关节滑膜组织。滑膜是关节囊的内层,淡红色,平滑闪光,薄而柔润,由疏松结缔组织组成。关节腔内的所有结构,除关节软骨、半月软骨板以外,即便是通过关节腔的肌腱、韧带等均全部为滑膜所包裹。滑膜分泌滑液,在关节活动中起重要作用。正常滑膜分为两层,即薄的细胞层(内腔层)和血管层(内膜下层),是血管丰富的关节囊内膜,贴附于非关节面部分,覆盖于关节囊内的骨面上,不在软骨面上,此部分称为边缘区或“裸区”。
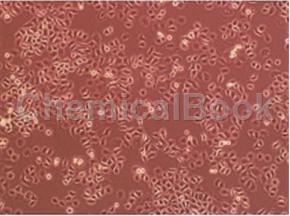
滑膜呈粉红色,光滑发亮、湿而润滑,有时可见绒毛,内含胶原性纤维。滑膜细胞有A、B两型。巨噬细胞样A型细胞,表面有丝状伪足、浆膜内陷、囊泡、线粒体、溶酶体、胞浆纤维和高尔基体,具有吞噬功能;B型成纤维样滑膜细胞(FLS),有高浓度的内质网结构,是介导RA关节破坏的主要细胞。
细胞特性:
1细胞来源于手术取得人正常关节滑膜组织。
2细胞鉴定:纤维连接蛋白(Fibronectin)或波形蛋白(Vimentin)免疫荧光染色为阳性。
3经鉴定细胞纯度高于90%。
4不含有HIV-1、HBV、HCV、支原体、细菌、酵母和真菌。
5细胞生长方式:成纤维样细胞,贴壁培养。
人关节滑膜成纤维细胞培养方法:
1.弃去培养上清,用不含钙、镁离子的PBS润洗细胞1-2次。
2.加2ml消化液(0.25%Trypsin-0.53mM EDTA)于培养瓶中,置于37℃培养箱中消化1-2分钟,然后在显微镜下观察Ⅱ型肺泡上皮细胞|细胞消化情况,若细胞大部分变圆并脱落,迅速拿回操作台,轻敲几下培养瓶后加少量培养基终止消化。
3.按6-8ml/瓶补加培养基,轻轻打匀后吸出,在1000RPM条件下离心4分钟,弃去上清液,补加1-2mL培养液后吹匀。
4.将细胞悬液按1:2到1:5的比例分到新的含8ml培养基的新皿中或者瓶中。
应用[7][8]
人关节滑膜成纤维细胞可用于滑膜成纤维细胞中促炎因子IL-6、VEGF影响骨关节炎病情进展的实验研究:
IL-6、VEGF在膝骨关节炎患者关节滑膜和滑液中的表达及其意义目的:检测不同阶段的膝骨关节炎(osteoarthritis,OA)患者关节滑膜组织和滑液中白细胞介素-6(Interleukin-6,IL-6)、血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)的表达情况,明确滑膜组织在OA发生发展过程中的作用,评价VEGF作为进展期OA标志的可行性。
方法:临床收集膝关节镜或关节置换手术患者的关节滑液和滑膜组织,根据X线平片的K-L分级进行分组。以K-L分级均为0级的单纯膝关节半月板损伤的患者作为对照组。酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)法检测各组关节液中IL-6、VEGF的含量,免疫组织化学染色方法检测IL-6、VEGF在滑膜组织中的原位表达。
结果:K-LⅡ、Ⅲ级的关节滑液中IL-6水平显著增高,差异有统计学意义;而K-LⅣ级患者关节滑液中IL-6水平下降接近对照组。各实验组的滑液中VEGF水平逐级增高,明显高于对照组。OA滑膜组织普遍存在不同程度的炎症,滑膜色泽变暗红,组织增生,甚至呈绒毛样增生改变。免疫组织化学染色显示,IL-6在滑膜衬里层及衬里下层细胞表达;VEGF在在滑膜衬里层及血管平滑肌细胞表达。结论:关节滑膜参与了骨关节炎的病理过程,滑膜产生的IL-6、VEGF很可能就是导致滑膜自身炎症慢性化、持续化的主要因素。滑液中VEGF水平的持续升高可作为判断OA病情活动的一个指标。
第二部分IL-6对体外培养的滑膜成纤维样细胞生物学行为的影响目的:观察IL-6对体外培养的滑膜成纤维样细胞(fibroblastlike synoviocyte,FLS)生物学行为的影响,探讨滑膜组织参与关节软骨破坏的作用机制。首先对关节置换手术切除的OA滑膜组织作原代细胞培养,通过流式细胞仪检测细胞表面CD3、CD14、CD90抗原的表达情况对细胞进行鉴定。
对3-5代的FLS分别予以不同浓度的IL-6、IL-1以及IL-6+IL-1刺激,ELISA法检测细胞上清液中VEGF、基质金属蛋白酶-13(matrix metalloproteinases,MMP-13)的含量,逆转录-聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)检测IL-6诱导的FLS中VEGF、MMP-13的mRNA表达。
参考文献
[1]Enhanced expression of interleukin-6,matrix metalloproteinase-13,and receptor activator of NF-κB ligand in cells derived from osteoarthritic subchondral bone[J].Kei Sakao,Kenji A.Takahashi,Osam Mazda,Yuji Arai,Hitoshi Tonomura,Atsuo Inoue,Masazumi Saito,Mikihiro Fujioka,Hisatake Takamiya,Jiro Imanishi,Toshikazu Kubo.Journal of Orthopaedic Science.2008(3)
[2]The effects of leflunomide on clinical parameters and serum levels of IL-6,IL-10,MMP-1 and MMP-3 in patients with resistant rheumatoid arthritis[J].Irena Litinsky,Daphna Paran,David Levartovsky,Irena Wigler,Ilana Kaufman,Ilana Yaron,Michael Yaron,Dan Caspi,Ori Elkayam.Cytokine.2006(2)
[3]The Role of IL‐1 and IL‐1Ra in Joint Inflammation and Cartilage Degradation[J].Claire Jacques,Marjolaine Gosset,Francis Berenbaum,Cem Gabay.Vitamins and Hormones.2006
[4]p38MAPK mediates IL-1-induced down-regulation of aggrecan gene expressionin human chondrocytes[J].Jürgen Radons,Anja Bosserhoff,Susanne Gr?ssel,Werner Falk,Thomas Schubert.International Journal of Molecular Medicine.2006(4)
[5]Causes of mechanically induced collagen damage in articular cartilage[J].Wouter Wilson,Christine van Burken,Corrinus van Donkelaar,Pieter Buma,Bert van Rietbergen,Rik Huiskes.J.Orthop.Res..2006(2)
[6]Enhancement of anti-inflammatory tendency by SB203580,p38αspecific inhibitor,in human fibroblast-like synoviocyte cell line,MH7A[J].Seon kyu Han,Su jin Jeon,Keiji Miyazawa,Seh yoon Yi,Young Sook Yoo.Rheumatology International.2006(11)
[7]Effects of doxycycline on progression of osteoarthritis:Results of a randomized,placebo‐controlled,double‐blind trial[J].Kenneth D.Brandt,Steven A.Mazzuca,Barry P.Katz,Kathleen A.Lane,Kenneth A.Buckwalter,David E.Yocum,FrederickWolfe,Thomas J.Schnitzer,Larry W.Moreland,SusanManzi,John D.Bradley,LeenaSharma,Chester V.Oddis,Steven T.Hugenberg,Louis W.Heck.Arthritis&Rheumatism.2005(7)
[8]朱宝玉.滑膜成纤维细胞中促炎因子IL-6、VEGF影响骨关节炎病情进展的实验研究[D].中南大学,2009.
