背景及概述[1][2]
铁蛋白的外壳为蛋白,其核心部分可含有不同量的铁,其含量从几乎没有到30%不等。血清铁蛋白可采用放射免疫法或酶免疫法测定。血清铁蛋白浓度是判断体内铁贮存量的重要指标。在诊断缺铁性贫血、铁负荷过度、营养状况调查都有重要意义。同时,各种恶性肿瘤患者血清铁蛋白增高,其中以白血病和恶性淋巴瘤增高最为显著。肝癌、胰腺癌、乳腺癌患者铁蛋白增高。铁蛋白在渗出性胸、腹水高于漏出性胸、腹水,可用于渗出液与漏出液的鉴别。铁蛋白的液/血比值在恶性胸、腹水病例明显升高,有助于鉴别良恶性胸、腹水。
结构特征[2]
生命体内的铁蛋白主要由蛋白质外壳和水合氧化铁核两部分构成,典型的铁蛋白是由二十四个亚基组成的高度对称的笼形结构。近年来的研究表明,亚基二聚体界面的侧链相互作用控制铁蛋白壳自组装形成笼形结构。不同生物体内铁蛋白结构相似,但其氨基酸序列却有着较大差异,如细菌与真核生物的氨基酸序列约有80%的差异。哺乳动物铁蛋白具有两种不同的亚基:H亚基(重链)和L亚基(轻链),其分子量约分别为21kDa和19kDa。不同种哺乳动物之间H亚基氨基酸序列约有90%的同源性,L亚基氨基酸序列约有85%的同源性,同种动物的H亚基和L亚基之间有54%的保守性。铁蛋白的H亚基与L亚基组成比率根据不同物种和不同组织而不尽相同,其铁蛋白核的粒径分布及矿物结构也有差异。在哺乳动物体内,铁存储量比较丰富的器官(如肝脏和脾脏),L亚基比例较高;而铁存储量较低的器官(如心脏和红细胞),H亚基比例较高,这可能是由于高L/H亚基比率具有较高的铁结合效率。
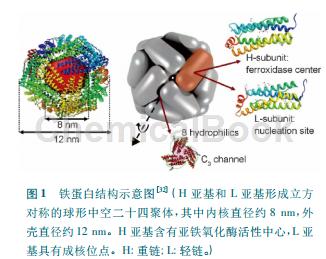
功能[3]
铁蛋白在生物体内具有两种主要功能:一是维持生物体内铁的代谢平衡。铁蛋白是普遍存在于生物体内的一种储存铁的蛋白质,其储存铁的过程主要包括Fe(Ⅱ)的氧化、Fe(Ⅲ)的转移、矿质铁核的形成和生长,从而能够将铁贮存在铁蛋白内部;二是能够通过清除铁介导的自由基而抑制Fenton反应,防止过量铁导致的氧化性胁迫。这是由于二价铁能活化过氧化氢,形成羟自由基,后者具有很强的氧化能力,能损伤细胞,导致细胞完整性的丧失,甚至引起细胞死亡。而铁蛋白通过截获细胞间的铁,从而阻止铁参与Fenton反应产生的羟自由基,而保护细胞免受因各种环境胁迫而导致的细胞氧化性损伤。
应用[2]
铁蛋白的表面修饰实质为蛋白质的修饰,在其多肽链上连接上某些分子,赋予铁蛋白新的功能,但其主要生物功能团如酶活性位点或配体识别位点仍保持活性。如前所述,铁蛋白是由24个亚基自组装形成的球状蛋白,这种球形中空结构具有三个界面:内表面、外表面以及亚基之间的接触面。外表面可用于连接具有特殊功能的配体,内表面可作为纳米反应器用于纳米复合材料的合成,亚基之间的接触面则可用于指导铁蛋白的解聚与重组、合成不同亚基比例的铁蛋白及打破铁蛋白的对称性结构。
铁蛋白的蛋白质外壳具有氨基、羧基、巯基等可供修饰的活性基团,可以利用化学方法进行修饰,同时针对铁蛋白的氨基酸序列,也可以通过生物修饰的方法实现对铁蛋白的精确修饰。20世纪70年代人们就已经尝试着对铁蛋白外表面进行化学修饰,通过连接上抗体应用于免疫电镜技术。用铁蛋白标记的抗体与抗原作用后,具有高致密度的铁蛋白能在电镜下观察到,从而用于检测和识别抗原抗体结合的部位,此技术还可用于细胞抗原成分的定位以及观察细胞形态和功能。而对铁蛋白的生物修饰则起步较晚,直至2004年美国学者Kramer在铁蛋白L亚基C端插入一段能将银离子转换成金属银的功能肽段,改造后的铁蛋白可利用硝酸银产生银纳米颗粒,从此开启了铁蛋白生物修饰的新篇章。
1. 化学修饰铁蛋白的应用
化学修饰通过在铁蛋白表面连接上不同的修饰物,包括抗体、荧光、酶、聚合物等,使其克服自身的不足或赋予其新的功能。利用抗体识别特异性抗原,可介导细胞间的特异性相互作用,连接上抗体的铁蛋白具有一定的靶向作用。铁蛋白最早的化学修饰是用戊二醛等双功能试剂将其与抗体连接,用铁蛋白标记的抗体与抗原作用,利用铁蛋白铁核的高致密度作为电镜标记,从而检测和识别抗原抗体结合的部位。Hainfeld等制备出免疫反应性高达92%的铁蛋白-抗体共轭物。Tang等用生物素-亲和素在铁蛋白表面连接抗人血浆铜蓝蛋白抗体,将含有铁核的铁蛋白作为过氧化物模拟酶,利用双抗夹心酶联免疫法(ELISA)检测人血浆铜蓝蛋白。
2. 铁蛋白生物修饰方法及其应用
铁蛋白的生物法修饰是一种通过基因重组技术进行的修饰,具有较高的专一性。铁蛋白的生物法修饰是通过在铁蛋白基因序列中加入特定的结合序列,通过合适的载体转入细菌体内,利用细菌表达出特定需求的新型多功能铁蛋白。利用基因重组技术几乎可以对铁蛋白的任何部位进行修饰。在超嗜热菌铁蛋白(Pf_Fn)亚基的N端融合表达可被凝血酶水解的肽段,并将位于蛋白壳内C端的甘氨酸用半胱氨酸替代用于特异性结合目的分子,再利用化学修饰在铁蛋白表面修饰上生物素以结合目标配体。当凝血酶将肽段劈开,铁蛋白C端结合的目的分子即暴露出来,形成了通过蛋白酶控制的多功能纳米输送平台。有多项研究通过基因工程方法在铁蛋白外表面连接特定的肽段或者荧光探针,用于活体细胞成像,例如Lee研究组通过一个富含甘氨酸的肽段将绿色荧光蛋白(GFP)整合到人H亚基铁蛋白外表面,增大了荧光强度并提高了稳定性,再利用化学修饰连接DNA适体用于肿瘤标志物的检测,其检测灵敏度显著增强。
主要参考资料
[1] 内科学·卷
[2] 铁蛋白表面修饰及其应用
[3] 铁蛋白:一种新型矿质元素营养强化剂载体
