背景[1-6]
Imperial Protein Stain是一种即用型比色染料,采用考马斯染料R-250配制而成,可在聚丙烯酰胺电泳凝胶中提供一致的纳克级蛋白质检测。Imperial Protein Stain是一种考马斯染料试剂,用于检测十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)和2D凝胶中的蛋白质条带。该染色剂是考马斯亮蓝R-250的独特配方,与自制或其他商业染色相比,可显着改善蛋白质染色性能。染色产生强烈着色的蛋白质条带,易于使用凝胶成像仪拍摄和记录。该试剂是可用的最灵敏的比色染料之一,每个条带容易检测3至6纳克蛋白质。Imperial Protein Stain方案使用简单的水洗步骤而不是甲醇/乙酸固定和脱色,这节省了宝贵的准备时间并限度地降低了试剂成本。
特点[1-6]
Imperial蛋白染色的特点:
•敏感-使用增强的方案检测每个带少于3ng蛋白质(3小时)
•快速使用的试剂在20分钟内检测到每个带少于6ng蛋白质
•稳健-高度一致,可重复的蛋白质染色技术
•高对比度-强烈的紫色条带比典型的考马斯蓝色斑点更容易拍摄或扫描
•多功能-与下游质谱分析和蛋白质测序兼容
•只需方便的水洗;无需酸固定剂或甲醇脱色溶液
•稳定的1年室温稳定性确保一致的性能并节省冰箱空间
•灵活调整染色和洗涤时间,以满足时间和灵敏度要求
Imperial Protein染色剂是考马斯亮蓝R-250的独特配方,与自制或其他市售的基于考马斯的染色剂相比,可显着改善蛋白质染色性能。易于遵循的协议可灵活满足苛刻的时间和灵敏度要求。使用Imperial Protein Stain不会导致与其他考马斯G-250染色制剂相关的问题(例如,染色一致性)。
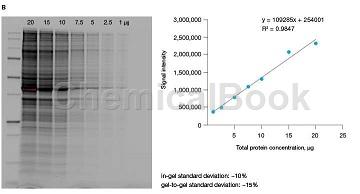
除了比标准考马斯G-250染色剂更快的蛋白质条带开发和更高的灵敏度外,Imperial Protein Stain不需要甲醇/乙酸固定和脱色,节省了宝贵的准备时间并限度地降低了试剂成本。
应用[7][8]
用于多巴胺醌对LDHB和ENO1酶活性的影响研究。
帕金森病作为一种常见的的神经退行性疾病,其发病原因尚不清楚。我们认为神经元细胞内游离的多巴胺能够氧化产生多巴胺醌,多巴胺醌能够结合并修饰蛋白,使蛋白功能丧失,导致细胞死亡。本实验用多巴胺对体外纯化的LDHB和ENO1酶蛋白进行处理,来研究多巴胺氧化产生的多巴胺醌对酶蛋白活性的影响,进而探究多巴胺醌毒性与帕金森病之间的关系。方法:体外扩增LDHB和ENO1酶蛋白基因序列,将两种蛋白基因序列分别连接进入表达载体pProEX-HTb。将重组表达质粒转化入BL21表达感受态菌中,利用IPTG(Isopropy1β-D-Thiogalactoside)诱导蛋白表达。超声破碎菌体提取蛋白,利用Ni-NTA亲和层析法对两种蛋白进行纯化。加入相应的酶底物,通过吸光度变化来检测酶生物活性。在不同条件下用多巴胺对酶蛋白进行处理,之后对样品的酶活性进行测定。将经过处理的样品进行变性聚丙烯酰胺凝胶电泳,利用考马斯染色法和NBT/甘氨酸盐显色法对蛋白样品进行分析。最后通过蛋白免疫印迹实验,分析LDHB蛋白样品中的醌结合蛋白。
结果:体外扩增的LDHB和ENO1蛋白基因序列测序无错配。诱导表达纯化的两种蛋白具有生物催化活性。用相同浓度的多巴胺对LDHB和ENO1蛋白处理不同时间之后,随着处理时间的增加,LDHB和ENO1蛋白酶活性的损失都增加。经过不同DA浓度处理相同时间后,随着DA处理浓度增加,两种蛋白酶活性损失增加,蛋白酶活性下降;若在处理样品中预加入谷胱甘肽(GSH),能够阻止酶活性的损失,使蛋白保持活性。酪氨酸酶催化多巴胺氧化生成多巴胺醌,但不会生成活性氧等产物,生成的多巴胺醌降低了蛋白酶催化活性,同样预加入谷胱甘肽后,蛋白活性损失消失。
考马斯染色结果显示经过多巴胺处理的蛋白样品中生成多聚物,多聚物的量与处理时间以及处理浓度成正比;NBT/甘氨酸盐染色结果表明处理样品中的多聚物,是由于多巴胺醌修饰产生的蛋白积聚。而谷胱甘肽能够阻止蛋白样品中多聚物形成。最后对LDHB蛋白进行Western Blots实验,结果表明处理的样品中的多聚物是醌结合的LDHB蛋白。结论:体外表达纯化的LDHB和ENO1蛋白具有一定的生物催化活性。纯化的LDHB和ENO1蛋白经过多巴胺处理,多巴胺氧化生成的多巴胺醌能够结合并修饰蛋白,使蛋白聚集形成多聚物,降低了蛋白酶活性。
参考文献
[1]Interaction ofα-synuclein with biomembranes in Parkinson’s disease—role of cardiolipin[J].Stephanie Ghio,Frits Kamp,Ruben Cauchi,Armin Giese,Neville Vassallo.Progress in Lipid Research.2016
[2]In vivo protein targets for increased quinoprotein adduct formation in aged substantia nigra[J].Guohua Yu,Huiyan Liu,Wei Zhou,Xuewei Zhu,Chao Yu,Na Wang,Yi Zhang,Ji Ma,Yulan Zhao,Yuanyuan Xu,Lujian Liao,Hongfang Ji,Chonggang Yuan,Jiyan Ma.Experimental Neurology.2015
[3]Role of membrane contact sites in protein import into mitochondria[J].Susanne E.Horvath,Heike Rampelt,Silke Oeljeklaus,Bettina Warscheid,Martin van der Laan,Nikolaus Pfanner.Protein Science.2015(3)
[4]Preconditioning as a Potential Strategy for the Prevention of Parkinson’s Disease[J].Mojtaba Golpich,Behrouz Rahmani,Norlinah Mohamed Ibrahim,Leila Dargahi,Zahurin Mohamed,Azman Ali Raymond,Abolhassan Ahmadiani.Molecular Neurobiology.2015(1)
[5]Protective and toxic roles of dopamine in Parkinson’s disease[J].Juan Segura‐Aguilar,Irmgard Paris,Patricia Mu?oz,Emanuele Ferrari,Luigi Zecca,Fabio A.Zucca.J.Neurochem..2014(6)
[6]Dopamine Cytotoxicity Involves Both Oxidative and Nonoxidative Pathways in SH-SY5Y Cells:Potential Role of Alpha-Synuclein Overexpression and Proteasomal Inhibition in the Etiopathogenesis of Parkinson’s Disease[J].Kalpita Banerjee,Soumyabrata Munshi,Oishimaya Sen,Vishmadeb Pramanik,Tapasi Roy Mukherjee,Sasanka Chakrabarti,Nobutaka Hattori.Parkinson’s Disease.2014
[7]Dopamine quinone modifies and decreases the abundance of the mitochondrial selenoprotein glutathione peroxidase 4[J].David N.Hauser,April A.Dukes,Amanda D.Mortimer,Teresa G.Hastings.Free Radical Biology and Medicine.2013
[8]魏代鑫.多巴胺醌对LDHB和ENO1酶活性的影响[D].华东师范大学,2017.
