背景及概述[1][2]
丁苯那嗪最早在瑞士上市,最初用于精神分裂症的治疗。在2008年8月经美国食品和药品管理局(FDA)以快速审批资格批准上市,成为首个且唯一的在美国治疗亨廷顿舞蹈症(HD)的药物。HD是一种遗传性、致死性脑部变性疾病,以人格改变、言语不清、情绪不稳、不自主运动和醉态为特征。通常于中年发病,由于大脑尾状核中细胞死亡,逐渐丧失说话、行动、思考和吞咽能力,病情大约会持续发展15~20年,并最终导致死亡。
丁苯那嗪主要通过可逆性的抑制中枢神经系统的单胺转运蛋白2(VMAT 2)来降低单胺类化合物,如5‑羟色胺,多巴胺和去甲肾上腺素等的供应从而产生药理活性。丁苯那嗪除了抑制VMAT 2外,同时还能对突触前和突触后多巴胺受体有一定的拮抗作用。丁苯那嗪是一个安全有效的治疗各种运动机能亢进障碍性疾病的药物,与传统的抗精神药相比,丁苯那嗪不会引起迟发型运动障碍。。
理化性质[1]
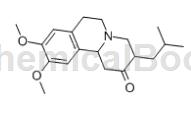
丁苯那嗪(Tetrabenazine,TBZ,Ro 1-9569)是苯并喹嗪类衍生物,它的化学名称为2-氧-3-异丁基-9,10-二甲氧基-1,2,3,4,6,7-六氢苯并[α]喹嗪(见图1)。丁苯那嗪于五十年代末在瑞士上市,最初用于精神分裂症的治疗。临床使用一段时间后发现,TBZ更是一个多巴胺受体阻断药。经过测试发现TBZ具有更加广泛的用途,特别是在运动机能亢进方面。2008年,TBZ成为美国首个通过FDA认证用于治疗亨廷顿舞蹈症的药物。丁苯那嗪主要通过可逆性的抑制中枢神经系统的单胺转运蛋白2(VMAT 2)来降低单胺类物质,如5-羟色胺,多巴胺和去甲肾上腺素等,的供应从而产生药理活性。TBZ除了抑制VMAT 2外,同时还对突触前和突触后多巴胺受体有一定的拮抗作用。
丁苯那嗪是一个安全有效的治疗各种运动机能亢进障碍性疾病的药物,与传统的抗精神病药相比,TBZ不会引起迟发性运动障碍。然而,TBZ还是会带来一些剂量相关的副反应,如镇静,帕金森综合症,抑郁,失眠和静坐不能等,所有副反应都是可逆的。虽然TBZ可能会引起一些副反应,但是总的来说还是相对安全的,出现严重副反应的几率很小,具有较好的耐受性。
丁苯那嗪有2个手性中心:3位和11b位。因为3位和11b位的氢处于反式时是热力学稳定构型,所以上市的TBZ是(3R,11bR)构型和(3S,11bS)构型的消旋体混合物。
丁苯那嗪在人体内迅速代谢成为二氢丁苯那嗪(DTBZ),这也是它的主要活性形式。因为TBZ是RR构型和SS构型的消旋体混合物,所以DTBZ也有四种形式:(+)-α-DTBZ(2R,3R,11bR),(-)-α-DTBZ(2S,3S,11bS),(+)-β-DTBZ(2S,3R,11bR)和(-)-β-DTBZ(2R,3S,11bS)。其中,(+)-α-DTBZ(2R,3R,11bR)与VMAT2具有最高的结合力,并在体内实验中体现出远强于其他三个异构体的药理活性。相应的,光学纯的(3R,11bR)-丁苯那嗪的体内药理活性也应该显著强于(3S,11bS)-丁苯那嗪。而(+)-丁苯那嗪在体外活性测试中表现出的VMAT-2的亲和力(Ki=4.61nM)是(-)-丁苯那嗪(Ki=11.20nM)的2.4倍。
制备[2]
(1)四甲基甲二胺的合成
在1 L三口瓶中,加入162 g甲醛水溶液,冷却至0~5 ℃后,缓慢滴加545 g二甲胺水溶液。自然升温到室温(28 ℃),搅拌8小时。将反应液冷却到0~5 ℃后,缓慢加入250 g氢氧化钾固体,分出有机相,用50 g氢氧化钠干燥。过滤后,常压蒸馏有机相得到172 g四甲基甲二胺,产率84%,HPLC纯度99%。
(2)3‑[(二甲基氨基)甲基]‑5‑甲基‑2‑己酮的合成
在1 L三口瓶中,加入240 ml N,N‑二甲基甲酰胺和122 g四甲基甲二胺,冷却至0~5 ℃后,滴加94 g乙酰氯,搅拌2小时。滴加123 g 5‑甲基‑2‑己酮,缓慢升温到70~75℃,搅拌8小时。降至室温(28 ℃)后,加480 ml水,再加入 200 ml乙酸乙酯和100 ml1M盐酸。分层后,水相用4 M氢氧化钠溶液调节PH值到10~11,再用乙酸乙酯(150 ml×3)萃取,合并有机相浓缩后减压蒸馏(20 mmHg,95~105℃)得到120 g 3‑[(二甲基氨基)甲基]‑5‑甲基‑2‑己酮,产率64%,HPLC纯度99%。
(3)丁苯那嗪的合成
搅拌下,将358 g 6,7‑二甲氧基‑3,4‑二氢异喹啉盐酸盐和236 g 3‑[(二甲基氨基)甲基]‑5‑甲基‑2‑己酮加入到 1000 mL 水中。再加1 g 丁苯那嗪晶种,室温下搅拌72小时。减压过滤得到大量固体,用300 mL水洗,再用300 mL正庚烷洗,50度真空干燥16小时得到347 g黄色固体丁苯那嗪,产率86%,HPLC纯度99%。
丁苯那嗪的拆分:
丁苯那嗪0.3g(0.95mmol)和(+)-樟脑磺酸0.11g(0.48mmol)溶于适量丙酮中,回流30分钟后,冷却析晶,过滤得到白色晶体(3R,11bR)-丁苯那嗪·(+)-樟脑磺酸盐(0.10g),[α]D25: +33.2(MeOH); 1H NMR(300MHz,MeOD)δ: 6.85(s,1H), 6.82(s,1H), 4.64-4.39(m,1H), 4.06-3.68(m,7H), 3.53-3.30(m,3H), 3.23-2.99(m,3H), 2.73-2.57(m,2H), 2.34(t,1H,J=9.3Hz), 2.28(t,1H,J=9.4Hz), 2.20-1.49(m,9H), 1.22-1.16(m,1H), 1.09(s,3H), 0.98-0.91(m,6H), 0.82(s,3H)。
该盐经解离后所得到的(3R,11bR)-丁苯那嗪游离碱的ee值为98.4%。
主要参考资料
[1] 姚彰彧. (2010). 光学纯丁苯那嗪的不对称合成尝试. 中国药科大学学报, 41(4), 321-325.
[2] 刘洋(编译), & 胡春(审校). (2009). 丁苯那嗪(xenazine). 中国药物化学杂志, 19(1), 80-80.
[3] 杨久匣, 张玉萍, 张红苗, & 晏培. (2009). 治疗舞蹈病药物——丁苯那嗪. 中国药学杂志, 44(12), 959-960.
