背景及概述[1]
亚硫酸锌白色结晶性粉末。能从空气中吸收氧气,被氧化成硫酸锌。热至100℃失去结晶水,变成无水盐。在200℃时分解为氧化锌和二氧化硫。微溶于冷水和乙醇,在热水中分解,能溶于亚硫酸或铵盐溶液。氢氧化锌与亚硫酸溶液相互作用而得。用作解剖标本或医药上的防腐剂。
酸分解[3]
固体ZnSO3容易被硫酸等酸分解,利用这一性质将ZnO悬浮液吸收SO2后得到的ZnSO3加酸分解,回收SO2和ZnSO4,也是ZnO脱硫产物综合利用的又一可行途径。在湿法炼锌企业,可用含硫酸达100gL以上的电解废液进行亚硫酸锌酸分解,分解后的ZnSO4溶液经净化即可送去电解锌;分解得到的高浓SO2可送制酸系统制酸或直接液化得液态SO2。总浓度迅速增加,而SO2微溶于水,20℃仅11.5g100gH2O,因此将有越来越多的SO2从液相逸出;当pH值>4.7后,ZnSO3溶解的量明显减少,其分解速度也明显变慢。其总反应为(1)式,具体过程由(2)至(7)式表示:
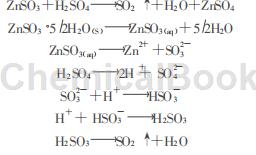
(1)氧化锌脱硫产物亚硫酸锌的酸分解路线是可行的,而且分解条件温和,反应速度快,对锌和硫的回收高效、彻底。(2)较高的温度能促进分解,但也易腐蚀设备而且能耗过高,通常70~90℃比较适宜。(3)终点pH值是影响ZnSO3分解反应的重要因素之一,通常应控制在3.0~4.0之间比较合适.(4)较高的真空度对分解有利,但过高的真空度已对分解反应帮助不大,而且会无端增大动力消耗;过低又使SO2的抽出过程延长。实验室中选择26.7~46.7kPa的真空条件为宜;工业上不便于实现较高的真空条件,可以采用适当延长抽气时间的办法来保证较高的分解率。(5)较高的浆液浓度对分解有利,但工业上待分解ZnSO3·52H2O浆液的浓度要受到脱硫过程浆液浓度的限制,在不影响吸收操作的条件下,脱硫过程应适当采用较高浓度的ZnO浆液作吸收剂。(6)一次性加酸方式更有利于分解反应,因而工业上可以考虑尽可能将酸集中加入。
制备[4]
一种用二氧化硫废气制备亚硫酸锌的方法,包括如下具体步骤:
步骤A:将二氧化硫废气按照氢氧化锌和二氧化硫纯物质质量比为1∶0.45-0.85通入盛有氢氧化锌溶液的搪瓷反应器(2)里,慢慢开动搅拌器使其进行化学反应,得到含亚硫酸锌的反应液;
步骤B:将步骤A所得的含亚硫酸锌的反应液经抽滤机(3)抽滤,得到澄清的亚硫酸锌溶液和少量的滤饼杂质,滤饼杂质焚烧;
步骤C:将步骤B所得的澄清的亚硫酸锌溶液送入蒸发器(4)里蒸发,使之达到亚硫酸锌饱和溶液,冷却,此时蒸发液已经成为亚硫酸锌晶体,经粉碎机粉碎、包装成为亚硫酸锌成品(5)。

主要参考资料
[1] 无机化合物辞典
[2] 亚硫酸锌空气氧化的研究
[3] 亚硫酸锌酸分解研究
[4] CN201010518920.4一种用二氧化硫废气制备亚硫酸锌的方法
