电池级氢氧化锂
| 中文名称 | 电池级氢氧化锂 |
|---|---|
| 中文同义词 | 一水合氢氧化锂(氢氧化锂);氢氧化锂,一水,ACS,≥98.0%;氢氧化锂,一水,AR,98%;氢氧化锂,一水,GR,≥99.0%(T);氢氧化锂,一水;氢氧化锂水合物;氢氧化锂一水合物;氢氧化锂单水合物 |
| 英文名称 | Lithium hydroxide monohydrate |
| 英文同义词 | LITHIUM HYDROXIDE-1-HYDRATE;Lithium hydroxide monohydrate 99.95% trace metals basis;Lithium hydroxide monohydrate 99.995% trace metals basis;Lithium hydroxide monohydrate ACS reagent, >=98.0%;Lithium hydroxide monohydrate puriss. p.a., >=99.0% (T);Lithium hydroxide monohydrate purum, >=98.5%;TSB (ACCORDING TO HARM EP) 1L;LITHIUM HYDROXIDE MONOHYDRATE, 98+%, A.C .S. REAGENT |
| CAS号 | 1310-66-3 |
| 分子式 | Li.HO.H2O |
| 分子量 | 41.96 |
| EINECS号 | 603-454-3 |
| 相关类别 | 微生物;无机化合物和盐;Cs氢氧化物;无机化工产品;无机盐;其他生化试剂;通用试剂;锂;信息化学品;催化和无机化学;化学试剂;稀有金属;氢氧化锂;Lithium Salts;Metal and Ceramic Science;Salts;Analytical Reagents for General Use;I-N, Puriss p.a.;Puriss p.a.;ACS GradeChemical Synthesis;Essential Chemicals;Inorganic Bases;Routine Reagents;化工原料;生化试剂;氢氧化物;材料中间体及助剂;化工;原料;有机原料;锂盐;医药原料;有机中间体;氢氧化物;化工品;其他中间体;其他原料;无机原料;医用原料;Synthetic Reagents;Chemical Synthesis;metal hydroxide |
| Mol文件 | 1310-66-3.mol |
| 结构式 | 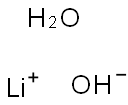 |
电池级氢氧化锂 性质
| 熔点 | 462 °C |
|---|---|
| 沸点 | 920 °C |
| 密度 | 1.51 |
| 储存条件 | Store at room temperature. |
| 溶解度 | H2O:1 Mat 20 °C,透明,无色 |
| 形态 | 固体 |
| 颜色 | 白色至奶油色或黄色 |
| 比重 | 1.51 |
| 气味 (Odor) | 无味 |
| 酸碱指示剂变色ph值范围 | 14 |
| PH值 | ~12 (25℃, 1M in H2O) |
| 水溶解性 | 109 g/L (20 ºC) |
| 敏感性 | Air Sensitive & Hygroscopic |
| 最大波长(λmax) | λ: 260 nm Amax: 0.02 λ: 280 nm Amax: 0.02 |
| Merck | 14,5534 |
| 稳定性 | 稳定的。与水分不相容。强酸、二氧化碳。会吸收空气中的二氧化碳。 |
| InChIKey | WMFOQBRAJBCJND-UHFFFAOYSA-M |
| CAS 数据库 | 1310-66-3(CAS DataBase Reference) |
| NIST化学物质信息 | LiOH(1310-66-3) |
| EPA化学物质信息 | Lithium hydroxide (Li(OH)), monohydrate (1310-66-3) |
氢氧化锂是一种强碱,化学性质与元素周期表中的第2族氢氧化物更为相似,而与第1族氢氧化物有较大差别。其为白色四方系晶体,对皮肤有强烈的腐蚀性和刺激性,熔点450℃,相对密度1.46。分解温度924℃。微溶于乙醇,溶于水,但溶解度低于其他碱金属的氢氧化物。在空气中吸湿后或在水溶液中结晶时均得到单水氢氧化锂。与二氧化硫、氯化氢、氰化氢等酸性气体反应。也能与强酸或弱酸在水溶液中完全反应。在空气中吸收二氧化碳生成碳酸锂。

1950年同位素6Li用作生产氢弹等热核武器的原料,美国原子能工业开始大量使用氢氧化锂,使锂工业获得惊人的发展。
锂及锂化物因其独特的化学和物理性质而广泛用于军事工业和民用工业。电解铝工业是锂的最大用户。铝电解中添加碳酸锂,可降低电解质熔点,提高铝电解槽的电流效率,从而使铝产量增加约10%,电耗降低8~14%;此外,还可以抑制22%~38%的有害氟排出。在美国和欧洲,铝工业消耗的碳酸锂量约占锂总量的40%。1,氢氧化锂在隔绝空气情况下,加温至600℃时,生成氧化锂和水,化学反应方程式:2LiOH=Li2O+H2O。
2,在加温条件下,氢氧化锂与镁或钙作用,均生成金属锂和相应的氧化物。(1)2LiOH+Mg=2Li+MgO+H2O (2)2LiOH+Ca=2Li+CaO+H2O
3,氢氧化锂与氯或碘作用,均生成卤化锂和次卤酸锂。(1)2LiOH+Cl2=LiCl+LiOCl+H2O (2)2LiOH+I2=LiI+LiOI+H2O
4,氢氧化锂与锌作用,形成锌酸锂和氢气,化学反应方程式:2LiOH+Zn=LiZnO2+H2。
5,氢氧化锂与酸发生中和反应,生成相应酸的锂盐(或水合锂盐)和水。(1)LiOH+HBO2+7H2O=LiBO2·8H2O(2)2LiOH+H3PO4=Li2HPO4+2H2O(3)2LiOH+H2SO4=Li2SO4+2H2O (4)LiOH(过量)+HClO4=LiClO4+H2O
6,氢氧化锂与氯化铵和四碘合汞(Ⅱ)酸锂的混合液、氯化钙或氯化钡作用,均能生成氯化锂。(1)4LiOH+2Li2HgI4+NH4Cl=LiCl+7LiI+Ohg2NH2I+3H2O(2)2LiOH+CaCl2=2LiCl+Ca(OH)2 (3)2LiOH+BaCl2=2LiCl+Ba(OH)2
以碳酸锂为原料,与氢氧化钙反应,可以制得单水氢氧化锂。在此反应中,由于两种原料的溶解度都比较小,所以必须充分搅拌。上述反应,只能得到含本品3.5%浓度的溶液,且碳酸锂的溶解度会由于氢氧化锂的生成而降低,并残存在碳酸钙的沉淀中而不溶解。所以,随着反应的进行,必须随时除去碳酸钙沉淀,并洗涤回收碳酸锂。除去碳酸钙沉淀后的母液,进一步减压浓缩,可析出一水合物,分离后,在130~140℃下干燥,可得一水合物。将一水合物在150~180℃ 下干燥,可制得无水氢氧化锂。
石灰烧结法锂辉石精矿(一般含氧化锂6%),与石灰石混合磨细,在1150~1250℃下烧结生成铝酸锂和硅酸钙,经湿磨粉碎,用洗液浸出氢氧化锂,经沉降过滤,浸出液经蒸发浓缩,结晶生成单水氢氧化锂成品,其反应式为:
Li2O+AI2O3+4SiO2+8CaO→Li2O+A12O3+4[2CaO+SiO2]
Li2O+AI2O3+Ca(OH)2→2LiOH+CaO+AI2O3
安全信息
| 危险品标志 | C |
|---|---|
| 危险类别码 | 22-35-20/22-34-52 |
| 安全说明 | 26-36/37/39-45-22-27 |
| 危险品运输编号 | UN 2680 8/PG 2 |
| WGK Germany | 2 |
| RTECS号 | OJ6307080 |
| F | 3-9-34 |
| TSCA | Yes |
| 危险等级 | 8 |
| 包装类别 | II |
| 海关编码 | 28252000 |
| 提供商 | 语言 |
|---|---|
|
中文
|
|
|
英文
|
|
|
英文
|
|
|
英文
|
|
|
中文
|
|
|
英文
|
| 更新日期 | 产品编号 | 产品名称 | CAS号 | 包装 | 价格 |
|---|---|---|---|---|---|
| 2025/02/08 | 8007471933 | 氢氧化锂,一水 Lithium hydroxide monohydrate | 25kg | 12125元 | |
| 2025/02/08 | 80074718 | 氢氧化锂,一水 lithium hydroxide monohydrate | 1310-66-3 | 500G | 761元 |
