钆双胺一水物
| 中文名称 | 钆双胺一水物 |
|---|---|
| 中文同义词 | 5,8-双(羧甲基)-2-[2-(甲胺基)-2-氧乙基]-10-氧代-2,5,8,11-四氮杂癸烷-1-羧酸钆一水物;钆双胺一水物;钆双胺水合物;5,8-双(羧基甲基)-11-[2- (甲氨基)-2-氧乙基]-3-氧-2,5,8,11-四氮杂十三烷-13-酸]钆X水合物;钆双胺一水合物 |
| 英文名称 | Gadodiamide |
| 英文同义词 | 2-[bis[2-[[2-(methylamino)-2-oxo-ethyl]-(2-oxidanidyl-2-oxo-ethyl)amino]ethyl]amino]ethanoate;2-[bis[2-[[2-(methylamino)-2-oxoethyl]-(2-oxido-2-oxoethyl)amino]ethyl]amino]acetate;2-[bis[2-[[2-keto-2-(methylamino)ethyl]-(2-keto-2-oxido-ethyl)amino]ethyl]amino]acetate;GadodiaMide(OMniscan);Gadodiamide hydrate;Gadolinium 5,8-bis(carboxylatomethyl)-2-[2-(methylamino)-2-oxoethyl]-10-oxo-2,5,8,11-tetraazadodecane-1-carboxylate hydrate;Gadolinium, aqua[5,8-bis(carboxymethyl)-11-[2-(methylamino)-2-oxoethyl]-3-oxo-2,5,8,11-tetraazatridecan-13-oato(3-)]-, hydrate;(TPS-9-156428397)-aqua[rel-(5R,11S)-5,8-bis[(carboxy-κO)methyl]-11-[2-(methylamino)-2-(oxo-κO)ethyl]-3-(oxo-κO)-2,5,8,11-tetraazatridecan-13-oato(3-)-κN5,κN8,κN11,κO13]-gadolinium,hydrate (1:x) |
| CAS号 | 122795-43-1 |
| 分子式 | C16H26GdN5O8.H2O |
| 分子量 | 591.673 |
| EINECS号 | 1533716-785-6 |
| 相关类别 | 小分子抑制剂,天然产物;原料;Inhibitors |
| Mol文件 | 122795-43-1.mol |
| 结构式 | 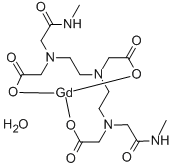 |
钆双胺一水物 性质
| 储存条件 | Inert atmosphere,Store in freezer, under -20°C |
|---|---|
| 形态 | 固体 |
| 颜色 | 白色至米白色 |
| 水溶解性 | ≥ 29.2mg/mL in Water |
钆双胺是顺磁性MRI造影剂,与钆喷酸葡胺相似。外观为白色粉末,无臭,易溶于水和甲醇,溶于乙醇,微溶于丙酮和氯仿。其不能通过健全的血脑屏障,注射后疾病所致血脑屏障失常区域可以明显增强,从而使所提供的诊断信息超过了未增强MRI。由于某些恶性分化程度较低或非活动性多发性硬化斑是不增强的,所以MRI上不显示增强时并不表明没有病变。
钆双胺注射后很快分布到细胞外液,其分布量与细胞外液中水量相等。其分布半衰期为4分钟,排泄半衰期约为70分钟。钆双胺通过肾小球滤过而经肾脏排泄。肾功能正常的病人注射4小时后约85%由尿液排泄,24小时后95%~98%被排泄。注射0.1~0.3mmol/kg时,未见与剂量有关的药代动力学变化。本品无代谢物可测出。也不与血浆蛋白结合。肾功能不全病人(GFR<30ml/min)排泄半衰期的延长程度与GFR值成反比。
【注意事项】 1.应考虑某些反应发生的可能性,包括严重的、威胁生命的、致命的、过敏性样的或心血管反应或特异性的反应,特别是对那些已知临床高敏性或有哮喘病史或其他的过敏性呼吸系统疾病的病人。
2.部分病人注射后血清铁离子浓度有短暂的变化(大多数病例在正常范围)。
3.本品对医院通常使用的比色(络合)法测定血清钙浓度有影响,对其他电解质的测定值也有影响(如铁离子)。因此建议使用后12~24小时内不要测定电解质浓度。
4.对一些严重肾功能不全的病人(GFR<10ml/min),在注射后可观察到GFR值有小幅下降,但无肾中毒症状。因这些发现的临床相关性还未知,对这些病人在使用前应小心。
5.目前尚无妊娠期妇女使用的经验。本品不应用于妊娠期妇女,除非MRI增强检查很有必要且无其他适当方法替代。
虽然预计分泌至人乳中的浓度极低,但分泌的程度仍然未知。给药前及给药后至少24小时内不应哺乳。

图1为钆双胺的结构式用于头颅、脊髓和身体一般磁共振成像(MRI)造影。本品能增强对比,有利于全身不同部位包括中枢神经系统异常结构或病灶的显示。已知对本品或其组成成分过敏者禁用。全部不良反应均短暂,大多数轻微。偶于注射部位有不适伴热感或冷感,或有局部压力感及痛感。头晕、恶心、头痛和嗅觉、味觉的减退则更少报道,罕见的反应有呕吐、瞌睡、感觉异常、视觉障碍、腹泻、焦虑、呼吸困难、胸痛、心动过速、震颤、关节痛或过敏样症状如荨麻疹、皮肤瘙痒或喉部刺激。过敏反应也可能发生。
同其他顺磁性MRI造影剂一样,注射后曾偶见惊厥。目前,两者间的因果关系仍有疑问。
临床试验中有一例发生短暂的肾衰。该病例在注射前22小时曾进行X射线脊髓造影,与本品的联系并未确立。
有关钆双胺的造影剂、适应证、禁忌、不良反应、用法用量是由Chemicalbook的东方编辑整理。(2016-03-02)静脉注射。
1.中枢神经系统:成人和儿童的推荐剂量为0.2ml/kg。对怀疑脑中有转移性疾病的病人,注射剂量为0.6ml/kg,可采用静脉团注。
2.全身:成人的推荐剂量通常为0.2~0.6ml/kg。6月以上儿童推荐剂量为0.2ml/kg。Gadodiamide Hydrate是一种含钆类磁共振成像造影剂,用于磁共振成像,协助血管可视化。Gadodiamide在大鼠,兔和猴中的半衰期分别为18,38,和75分钟。Gadodiamide主要通过肾脏被迅速排出。 Gadodiamide静脉给药0.3 毫摩尔/ kg,在体内稳定,并且99%的Gadodiamide被排泄在尿中。 Gadodiamide产生全身性肌阵挛超过数小时。Gadodiamide本身产生中央小脑区域的病变,类似于gadodiamide,而不是其它。 Gadodiamide在2分钟内从侧脑室注射处迅速传播遍及第四脑室钩椎和马让迪和椎间孔脑室系统。 在麻醉犬中,Gadodiamide会导致短暂的,但统计上显著降低的主动脉压,左室内压,左室收缩和放松,以及全身和肺血管阻力指数,并增加了主动脉的血流量。Gadodiamide注射产生比 gadopentetate dimeglumine次严重的改变血流动力学。
钆双胺注射后很快分布到细胞外液,其分布量与细胞外液中水量相等。其分布半衰期为4分钟,排泄半衰期约为70分钟。钆双胺通过肾小球滤过而经肾脏排泄。肾功能正常的病人注射4小时后约85%由尿液排泄,24小时后95%~98%被排泄。注射0.1~0.3mmol/kg时,未见与剂量有关的药代动力学变化。本品无代谢物可测出。也不与血浆蛋白结合。肾功能不全病人(GFR<30ml/min)排泄半衰期的延长程度与GFR值成反比。
【注意事项】 1.应考虑某些反应发生的可能性,包括严重的、威胁生命的、致命的、过敏性样的或心血管反应或特异性的反应,特别是对那些已知临床高敏性或有哮喘病史或其他的过敏性呼吸系统疾病的病人。
2.部分病人注射后血清铁离子浓度有短暂的变化(大多数病例在正常范围)。
3.本品对医院通常使用的比色(络合)法测定血清钙浓度有影响,对其他电解质的测定值也有影响(如铁离子)。因此建议使用后12~24小时内不要测定电解质浓度。
4.对一些严重肾功能不全的病人(GFR<10ml/min),在注射后可观察到GFR值有小幅下降,但无肾中毒症状。因这些发现的临床相关性还未知,对这些病人在使用前应小心。
5.目前尚无妊娠期妇女使用的经验。本品不应用于妊娠期妇女,除非MRI增强检查很有必要且无其他适当方法替代。
虽然预计分泌至人乳中的浓度极低,但分泌的程度仍然未知。给药前及给药后至少24小时内不应哺乳。

图1为钆双胺的结构式用于头颅、脊髓和身体一般磁共振成像(MRI)造影。本品能增强对比,有利于全身不同部位包括中枢神经系统异常结构或病灶的显示。已知对本品或其组成成分过敏者禁用。全部不良反应均短暂,大多数轻微。偶于注射部位有不适伴热感或冷感,或有局部压力感及痛感。头晕、恶心、头痛和嗅觉、味觉的减退则更少报道,罕见的反应有呕吐、瞌睡、感觉异常、视觉障碍、腹泻、焦虑、呼吸困难、胸痛、心动过速、震颤、关节痛或过敏样症状如荨麻疹、皮肤瘙痒或喉部刺激。过敏反应也可能发生。
同其他顺磁性MRI造影剂一样,注射后曾偶见惊厥。目前,两者间的因果关系仍有疑问。
临床试验中有一例发生短暂的肾衰。该病例在注射前22小时曾进行X射线脊髓造影,与本品的联系并未确立。
有关钆双胺的造影剂、适应证、禁忌、不良反应、用法用量是由Chemicalbook的东方编辑整理。(2016-03-02)静脉注射。
1.中枢神经系统:成人和儿童的推荐剂量为0.2ml/kg。对怀疑脑中有转移性疾病的病人,注射剂量为0.6ml/kg,可采用静脉团注。
2.全身:成人的推荐剂量通常为0.2~0.6ml/kg。6月以上儿童推荐剂量为0.2ml/kg。Gadodiamide Hydrate是一种含钆类磁共振成像造影剂,用于磁共振成像,协助血管可视化。Gadodiamide在大鼠,兔和猴中的半衰期分别为18,38,和75分钟。Gadodiamide主要通过肾脏被迅速排出。 Gadodiamide静脉给药0.3 毫摩尔/ kg,在体内稳定,并且99%的Gadodiamide被排泄在尿中。 Gadodiamide产生全身性肌阵挛超过数小时。Gadodiamide本身产生中央小脑区域的病变,类似于gadodiamide,而不是其它。 Gadodiamide在2分钟内从侧脑室注射处迅速传播遍及第四脑室钩椎和马让迪和椎间孔脑室系统。 在麻醉犬中,Gadodiamide会导致短暂的,但统计上显著降低的主动脉压,左室内压,左室收缩和放松,以及全身和肺血管阻力指数,并增加了主动脉的血流量。Gadodiamide注射产生比 gadopentetate dimeglumine次严重的改变血流动力学。
安全信息
| 更新日期 | 产品编号 | 产品名称 | CAS号 | 包装 | 价格 |
|---|---|---|---|---|---|
| 2025/02/08 | HY-B0266 | 钆双胺一水物 Gadodiamide hydrate | 122795-43-1 | 100mg | 500元 |
| 2025/02/08 | HY-B0266 | 钆双胺一水物 Gadodiamide hydrate | 122795-43-1 | 10mM * 1mLin DMSO | 550元 |
