铯
| 中文名称 | 铯 |
|---|---|
| 中文同义词 | 氯化銫;铯;铯球状;金属铯;金属铯安培瓶;铯ICP检测用标样;铯原子吸收标准物质;铯, 99.8% (METALS BASIS) |
| 英文名称 | Cesium |
| 英文同义词 | Cesium Metal in breakseal ampoule;"Cesium Metal, ampouled";Caesium, Breakseal Ampoule 99.98%;CesiuM, 99.95+%, (trace Metal basis);CESIUM ICP STANDARD TRACEABLE TO SRM FRO;CESIUM STANDARD SOLUTION 100 ML;CesiuM ingot, >=99.95% trace Metals basis;CesiuM puruM, >=99.5% |
| CAS号 | 7440-46-2 |
| 分子式 | Cs |
| 分子量 | 132.91 |
| EINECS号 | 231-155-4 |
| 相关类别 | 铯;微生物;Cu单质;无机化工产品;无机盐;单质;无机化工;Alkali MetalsMetal and Ceramic Science;Cesium;Metals;Reduction;Synthetic Reagents;分析标准品;通用试剂;标准品和标准物质;无机单元素标准溶液;有机标准溶液;化工原料;metal or element |
| Mol文件 | 7440-46-2.mol |
| 结构式 | 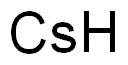 |
铯 性质
| 熔点 | 28.5 °C (lit.) |
|---|---|
| 沸点 | 705 °C (lit.) |
| 密度 | 1.873 g/mL at 25 °C (lit.) |
| 蒸气压 | 1 mm Hg ( 279 °C) |
| 储存条件 | 2-8°C |
| 溶解度 | 可溶于水中 |
| 形态 | 铸锭状 |
| 颜色 | 银色 |
| 比重 | 1.892 |
| PH值 | 0.5 (20°C in H2O) |
| Flame Color | Blue violet |
| 电阻率 (resistivity) | 19 μΩ-cm, 0°C |
| 水溶解性 | reacts with H2O to evolve H2; soluble liquid NH3 [MER06] |
| 敏感性 | moisture sensitive |
| Merck | 13,2018 |
| 暴露限值 | ACGIH: TWA 2 ppm; STEL 4 ppm OSHA: TWA 2 ppm(5 mg/m3) NIOSH: IDLH 25 ppm; TWA 2 ppm(5 mg/m3); STEL 4 ppm(10 mg/m3) |
| 稳定性 | 易燃固体;粉末状高度易燃。湿气敏感。与氯、磷、水不相容。 |
| CAS 数据库 | 7440-46-2(CAS DataBase Reference) |
| EPA化学物质信息 | Cesium (7440-46-2) |
铯,原子量132.90545(2)。原子序数55。银白色六方晶系金属(单质的洁净面显金黄色)。质轻软且可延。熔点28.55±0.16℃,沸点669.5℃,相对密度1.873。在碱金属中,是电正性最高的强碱性元素。与冷水反应发生爆炸。-116℃时,仍可与水反应。可溶于液氨,生成氨基化合物和氢气。能与卤素、磷、硫直接反应生成相应二元化合物。存在于铯榴石、光卤石以及鳞云母矿中。由电解熔融氯化铯而得。极纯的气态铯可由叠氮化铯的热分解而制得。铯单质主要用于制造光电管、摄谱仪、闪烁计数器、电子管、红外信号灯、以及光学自动控制仪器,还用于电子管的吸氧剂。医疗中用铯盐做药物。同位素铯-137,可用来治疗癌症。

1860年德国化学家本森(R.Bunsen)和基尔霍夫 (G.R.Kirchoff) 在研究矿泉水的光谱时发现铯,这是第一个用光谱法发现的元素,根据其光谱线的颜色按拉丁文Caesius(天蓝色)取名为Cesium(铯)。塞特伯格(C.Setterberg)于1881年电解氰化铯-氰化钡混合熔盐时,首次制得金属铯。铯在制得以后60余年中未获工业应用。1926年开始用铯制造光电管,但用量极小。第一次世界大战前只有德国生产少量铯,产量仅几千克。20世纪30年代美国开始生产铯。第二次世界大战期间,铯作为光敏材料,用量增加,但由于铯价格昂贵而稀少,应用受到限制。1957年美国研究成功从锂云母提锂后的母液——混合碳酸碱液(含Cs2O2%和Rb2O23%)中回收铯、铷的方法,导致铯产量骤增。铯作为锂生产的副产品,成本低,价格也随之显著下降,从而大大推动了铯的应用和对铯性质的研究。20世纪60年代以来,铯在原子钟、光学仪器、激光、有机合成等方面获得应用,同时还开发了多种提铯方法,使铯的提取冶金技术达到相当水平,产品质量不断提高,价格进一步下降。中国于1956年开始铯的冶炼研究,60年代初开始生产铯,相继开发了新疆、江西、四川等省的铯资源,现已能生产20余种铯、铷产品,满足国内经济发展和科学研究对铯的需要。金属铯为体心立方晶体结构,质软,有延性,可用刀切割。铯原子的外电子层构型为[Xe]6s1。在碱金属中铯的熔点和沸点最低,蒸气压最高,密度最大,导热性和导电性最好,电离电位最小。铯有22种同位素,其质量数在123~144之间。自然界中的133Cs为稳定同位素。放射性同位素137Cs是原子反应堆的聚变产物,半衰期为30.23a。

图1为铯的主要物理性质
有关铯的概述、物理性质、化学性质、制备方法等是由Chemicalbook的侍艳编辑整理。(2015-11-16)铯具有所有碱金属的化学特性,是碱金属化学反应活性最强的元素。常见的铯化合价为正一价,由Cs+→Cs0的还原电位为-2.923V。铯和铷性质相近,较难分离。金属铯在空气中燃烧时会喷溅出浓密的碱性烟雾,这种碱性烟雾能伤害眼睛、呼吸系统和皮肤。铯在潮湿的空气中氧化放出的热量足以使铯点燃并熔化。铯和氧剧烈反应生成多种氧化物的混合物。铯有Cs-1(s2)和Cs+两种氧化态。铯与水作用会发生强烈爆炸,甚至与157K温度的冰接触也剧烈反应,生成氢氧化物,放出氢气。和锂不同,铯不与氮反应。铯在高温下与氢反应生成相当稳定的氢化物。铯和乙炔反应生成乙炔化物。铯和卤素剧烈反应不同于其他碱金属与卤素的反应,铯能生成稳定的多卤化物,如CsI3。铯和氨反应生成氨基化铯 (CsNH2)。在低温下铯和CO反应生成一种组成不定的晶体化合物。碳酸铯可被金属镁还原成金属铯,氯化铯可被钙还原。铯和其他碱金属可形成低熔点的液体合金,如Cs-12Na-47K合金,其熔点195K;Cs~13Rb合金,其熔点234K;Cs-55Na合金,其熔点244K。铯盐可生成极难溶的矾,如CsCl·SbCl3。冶炼上利用铯矾的难溶特性来分离铯,分析上用以定量测定铯的含量。

图2为铯的主要化合物及其基本性质铯的地壳丰度是锂、钠、钾、铷、铯五种碱金属元素中最小的,为2.6×10-4%,海水含铯5×10-8%。铯常和锂、铷、钾共生。虽然铯比铷的地壳丰度小得多,但铯有工业用独立矿物。
锂云母是提取铯的主要资源之一。一些锂云母矿含铯较高,如美国加利福尼亚的锂云母矿含CszOO.30%,前苏联科拉半岛的锂云母含Cs20 O.24%。津巴布韦比基塔地区的锂云母储量大,但仅含cs。OO.08%。铯榴石是铯的重要工业资源,主要产于美国的缅因州、加拿大的伯尼克湖、津巴布韦的比基塔地区和纳米比亚的卡里比布}此外,亦有少量产于瑞典、莫桑比克及东哈萨克斯坦。一般铯榴石含铯甚高,含锂、铷较低,有的甚至含铷很少。如美国缅因州的铯榴石含Csz0 36%、Li20 0.04%,前苏联科拉半岛的铯榴石含Cs20 27.1%,意大利厄尔巴岛的铯榴石含Cs:O 34%(Liz0痕量)。中国新疆的铯榴石含Cs:0 29%~30%。以上矿物几乎都不含铷。此外,加拿大伯尔尼克湖的铯榴石含Cs20 28.6%、Rb20 1.36%、Li20 O.31%;津巴布韦比基塔的铯榴石含Cs20 22.4%、Rb20O.84%、Li20 O.30%。光卤石也是铯的重要来源,主要产于德国。前苏联科拉半岛拥有世界最大的光卤石产地。盐湖、地下卤水、气田水、油井水、温泉水及地热水都蕴藏有大量的铯,有的含铯量比较高。如美国索尔顿的湖水含cszO(16~21)×10-‘%,伍德湖油田水含Csa0 25×10-‘%。世界已查明的铯总储量为120000t,其中加拿大80000t,津巴布韦25000t,纳米比亚10000t。中国铯资源丰富,主要分布在江西的宜春、新疆的可可托海、四川的康定、湖南的香花岭和青海。江西的锂云母含Cs20 O.3%、Rb。0 1.72%,是中国最大的铯资源基地。中国盐湖卤水多,铯资源丰富,青藏高原卤水平均含cs。0 O.03g/L,四川的自贡卤水中的铯也已得到开发利用。

图3为主要的铯矿物使铯榴石与氧化钙、氯化钙一起煅烧,可制得氯化铯,再经熔融电解,可制得金属铯。
2CsAlSi2O6+3CaO+CaCl2→ 2CsCl+Al2O3+4CaSiO3
2CsCl→2Cs+Cl2主要包括铯提取(制取化合物)和金属铯制取两大步骤。有时为了获得高纯金属铯产品,需进行高纯金属铯制取。铯提取是从锂云母、铯榴石和光卤石等铯原料中提取铯化合物的过程。铯榴石提铯、铷有铯榴石盐酸法分解、铯榴石硫酸法分解、碱性熔盐焙烧、氯化焙烧和矿石直接还原等方法。工业上主要采用前两种方法。从铯原料中提取的铯化物常含有一定数量的杂质,需采用诸如溶剂萃取法提铯等方法制取纯的铯化合物,从铯榴石生产金属铯的工艺过程如图。
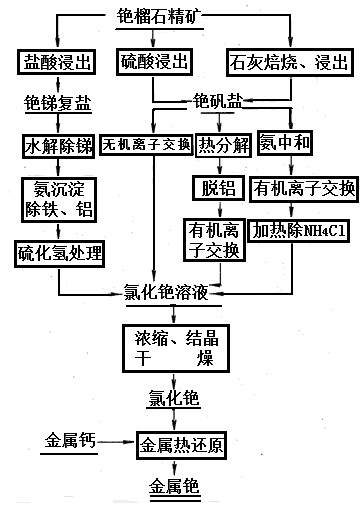
图4为从铯榴石生产金属铯的工艺流程铯及其化合物主要用于高技术的研究和开发,如用于磁流体发电、热离子发电、涡轮发电及离子推进技术的研究和开发,这些技术都处在开发阶段。美国高技术用铯量占铯总用量的50%~70%。铯的工业应用主要是电子工业、玻璃陶瓷和药物。铯及其化合物的性质和铷类似,在许多应用场合二者可以互代,但铯的某些性质优于铷,如铯的光电转换灵敏度比铷高。磁流体发电是使各种燃料产生的高温导电流通过强磁场,在电感应作用下由热能直接转换成电能,铯作为诱导材料加入到燃料中,可降低燃料离子化所需温度,改善离子焰传导性,增加所产生的能量。一座60万kW磁流-蒸气联合电厂每年约需用3000t碳酸铯。热电换能器是利用热电子发射现象产生大电流输出的二极管,将热能直接转换为电能,用铯制作的二极管可以提高热离子发电机的发电效率。气化的金属铯被离子化后,在电场作用下可加速到接近光速,再被电子束中和并从引擎中喷出,能产生强大的推动力。以铯为推进剂的火箭发动机比冲可达2000s (大多数化学燃料比冲仅300~400s)。一艘带有500g铯的离子推进宇宙飞船的航程大约是常用燃料飞船的150倍。普通光线的能量就足以使铯游离出价电子,铯的这一特性被用于制造光电管、摄谱仪、无线电电子管、军用红外信号灯及各种光学仪器和检测仪器中,使用铯光电池电源的寻靶导弹头,可跟踪、拦截敌方的飞行物。电视技术中采用铯阴极制造的低压电子束摄像管。铯的卤化物具有发光性能,用于制造闪烁计数器。钠激活的碘化铯对X射线的阻挡能力比其他卤化物大得多,用其制造的图像增强管具有很高的分辨力、强度和稳固性,使医用X光机不用暗室就可供多人观察而不受X射线的辐射。许多国家用铯原子钟作频率和时间标准,其精度达到1×10-13s,广泛用于通讯、运输、军事和宇航工业。硝酸铯是多成分特种玻璃的光折射调整剂,广泛用于光学纤维和纤维质透镜生产。铯的化学活性大,电离电位低,能改变主催化剂的表面性质,含铯的催化剂具有更好的催化活性、选择性和稳定性,可延长催化剂使用寿命,防止催化剂中毒。含铯的催化剂广泛用于氨合成,硫酸生产以及有机物的氧化、氢化、聚合、腈的形成等有机合成。铯盐具有镇静作用,可用于制造安眠药、镇静剂、癫痫治疗剂。137Cs作为放射性同位素标记用作诊断肿瘤,并正在取代60Co治疗癌症。氯化铯用于超速离心分离病毒、脱素核糖酸和其他大分子的密度-梯度介质。铯在冶金工业上被用作脱气剂和精炼剂。极易引起火灾。接触潮湿空气着火,与空气中的氧反应生成超氧化物,当混有有机物时,产生爆炸性的反应。与水或酸接触剧烈反应,并放出氢气引起燃烧。与卤素、硫黄和氧化剂接触剧烈反应。毒性比钠更强,但尚无因铯而引起中毒病例报道。铯主要对眼睛、皮肤和黏膜有强刺激性和腐蚀性。大鼠腹腔LD50:89 mg/kg。发生灼伤时,立即用水冲洗,伤口保洁,速送医院诊治。

1860年德国化学家本森(R.Bunsen)和基尔霍夫 (G.R.Kirchoff) 在研究矿泉水的光谱时发现铯,这是第一个用光谱法发现的元素,根据其光谱线的颜色按拉丁文Caesius(天蓝色)取名为Cesium(铯)。塞特伯格(C.Setterberg)于1881年电解氰化铯-氰化钡混合熔盐时,首次制得金属铯。铯在制得以后60余年中未获工业应用。1926年开始用铯制造光电管,但用量极小。第一次世界大战前只有德国生产少量铯,产量仅几千克。20世纪30年代美国开始生产铯。第二次世界大战期间,铯作为光敏材料,用量增加,但由于铯价格昂贵而稀少,应用受到限制。1957年美国研究成功从锂云母提锂后的母液——混合碳酸碱液(含Cs2O2%和Rb2O23%)中回收铯、铷的方法,导致铯产量骤增。铯作为锂生产的副产品,成本低,价格也随之显著下降,从而大大推动了铯的应用和对铯性质的研究。20世纪60年代以来,铯在原子钟、光学仪器、激光、有机合成等方面获得应用,同时还开发了多种提铯方法,使铯的提取冶金技术达到相当水平,产品质量不断提高,价格进一步下降。中国于1956年开始铯的冶炼研究,60年代初开始生产铯,相继开发了新疆、江西、四川等省的铯资源,现已能生产20余种铯、铷产品,满足国内经济发展和科学研究对铯的需要。金属铯为体心立方晶体结构,质软,有延性,可用刀切割。铯原子的外电子层构型为[Xe]6s1。在碱金属中铯的熔点和沸点最低,蒸气压最高,密度最大,导热性和导电性最好,电离电位最小。铯有22种同位素,其质量数在123~144之间。自然界中的133Cs为稳定同位素。放射性同位素137Cs是原子反应堆的聚变产物,半衰期为30.23a。

图1为铯的主要物理性质
有关铯的概述、物理性质、化学性质、制备方法等是由Chemicalbook的侍艳编辑整理。(2015-11-16)铯具有所有碱金属的化学特性,是碱金属化学反应活性最强的元素。常见的铯化合价为正一价,由Cs+→Cs0的还原电位为-2.923V。铯和铷性质相近,较难分离。金属铯在空气中燃烧时会喷溅出浓密的碱性烟雾,这种碱性烟雾能伤害眼睛、呼吸系统和皮肤。铯在潮湿的空气中氧化放出的热量足以使铯点燃并熔化。铯和氧剧烈反应生成多种氧化物的混合物。铯有Cs-1(s2)和Cs+两种氧化态。铯与水作用会发生强烈爆炸,甚至与157K温度的冰接触也剧烈反应,生成氢氧化物,放出氢气。和锂不同,铯不与氮反应。铯在高温下与氢反应生成相当稳定的氢化物。铯和乙炔反应生成乙炔化物。铯和卤素剧烈反应不同于其他碱金属与卤素的反应,铯能生成稳定的多卤化物,如CsI3。铯和氨反应生成氨基化铯 (CsNH2)。在低温下铯和CO反应生成一种组成不定的晶体化合物。碳酸铯可被金属镁还原成金属铯,氯化铯可被钙还原。铯和其他碱金属可形成低熔点的液体合金,如Cs-12Na-47K合金,其熔点195K;Cs~13Rb合金,其熔点234K;Cs-55Na合金,其熔点244K。铯盐可生成极难溶的矾,如CsCl·SbCl3。冶炼上利用铯矾的难溶特性来分离铯,分析上用以定量测定铯的含量。

图2为铯的主要化合物及其基本性质铯的地壳丰度是锂、钠、钾、铷、铯五种碱金属元素中最小的,为2.6×10-4%,海水含铯5×10-8%。铯常和锂、铷、钾共生。虽然铯比铷的地壳丰度小得多,但铯有工业用独立矿物。
锂云母是提取铯的主要资源之一。一些锂云母矿含铯较高,如美国加利福尼亚的锂云母矿含CszOO.30%,前苏联科拉半岛的锂云母含Cs20 O.24%。津巴布韦比基塔地区的锂云母储量大,但仅含cs。OO.08%。铯榴石是铯的重要工业资源,主要产于美国的缅因州、加拿大的伯尼克湖、津巴布韦的比基塔地区和纳米比亚的卡里比布}此外,亦有少量产于瑞典、莫桑比克及东哈萨克斯坦。一般铯榴石含铯甚高,含锂、铷较低,有的甚至含铷很少。如美国缅因州的铯榴石含Csz0 36%、Li20 0.04%,前苏联科拉半岛的铯榴石含Cs20 27.1%,意大利厄尔巴岛的铯榴石含Cs:O 34%(Liz0痕量)。中国新疆的铯榴石含Cs:0 29%~30%。以上矿物几乎都不含铷。此外,加拿大伯尔尼克湖的铯榴石含Cs20 28.6%、Rb20 1.36%、Li20 O.31%;津巴布韦比基塔的铯榴石含Cs20 22.4%、Rb20O.84%、Li20 O.30%。光卤石也是铯的重要来源,主要产于德国。前苏联科拉半岛拥有世界最大的光卤石产地。盐湖、地下卤水、气田水、油井水、温泉水及地热水都蕴藏有大量的铯,有的含铯量比较高。如美国索尔顿的湖水含cszO(16~21)×10-‘%,伍德湖油田水含Csa0 25×10-‘%。世界已查明的铯总储量为120000t,其中加拿大80000t,津巴布韦25000t,纳米比亚10000t。中国铯资源丰富,主要分布在江西的宜春、新疆的可可托海、四川的康定、湖南的香花岭和青海。江西的锂云母含Cs20 O.3%、Rb。0 1.72%,是中国最大的铯资源基地。中国盐湖卤水多,铯资源丰富,青藏高原卤水平均含cs。0 O.03g/L,四川的自贡卤水中的铯也已得到开发利用。

图3为主要的铯矿物使铯榴石与氧化钙、氯化钙一起煅烧,可制得氯化铯,再经熔融电解,可制得金属铯。
2CsAlSi2O6+3CaO+CaCl2→ 2CsCl+Al2O3+4CaSiO3
2CsCl→2Cs+Cl2主要包括铯提取(制取化合物)和金属铯制取两大步骤。有时为了获得高纯金属铯产品,需进行高纯金属铯制取。铯提取是从锂云母、铯榴石和光卤石等铯原料中提取铯化合物的过程。铯榴石提铯、铷有铯榴石盐酸法分解、铯榴石硫酸法分解、碱性熔盐焙烧、氯化焙烧和矿石直接还原等方法。工业上主要采用前两种方法。从铯原料中提取的铯化物常含有一定数量的杂质,需采用诸如溶剂萃取法提铯等方法制取纯的铯化合物,从铯榴石生产金属铯的工艺过程如图。

图4为从铯榴石生产金属铯的工艺流程铯及其化合物主要用于高技术的研究和开发,如用于磁流体发电、热离子发电、涡轮发电及离子推进技术的研究和开发,这些技术都处在开发阶段。美国高技术用铯量占铯总用量的50%~70%。铯的工业应用主要是电子工业、玻璃陶瓷和药物。铯及其化合物的性质和铷类似,在许多应用场合二者可以互代,但铯的某些性质优于铷,如铯的光电转换灵敏度比铷高。磁流体发电是使各种燃料产生的高温导电流通过强磁场,在电感应作用下由热能直接转换成电能,铯作为诱导材料加入到燃料中,可降低燃料离子化所需温度,改善离子焰传导性,增加所产生的能量。一座60万kW磁流-蒸气联合电厂每年约需用3000t碳酸铯。热电换能器是利用热电子发射现象产生大电流输出的二极管,将热能直接转换为电能,用铯制作的二极管可以提高热离子发电机的发电效率。气化的金属铯被离子化后,在电场作用下可加速到接近光速,再被电子束中和并从引擎中喷出,能产生强大的推动力。以铯为推进剂的火箭发动机比冲可达2000s (大多数化学燃料比冲仅300~400s)。一艘带有500g铯的离子推进宇宙飞船的航程大约是常用燃料飞船的150倍。普通光线的能量就足以使铯游离出价电子,铯的这一特性被用于制造光电管、摄谱仪、无线电电子管、军用红外信号灯及各种光学仪器和检测仪器中,使用铯光电池电源的寻靶导弹头,可跟踪、拦截敌方的飞行物。电视技术中采用铯阴极制造的低压电子束摄像管。铯的卤化物具有发光性能,用于制造闪烁计数器。钠激活的碘化铯对X射线的阻挡能力比其他卤化物大得多,用其制造的图像增强管具有很高的分辨力、强度和稳固性,使医用X光机不用暗室就可供多人观察而不受X射线的辐射。许多国家用铯原子钟作频率和时间标准,其精度达到1×10-13s,广泛用于通讯、运输、军事和宇航工业。硝酸铯是多成分特种玻璃的光折射调整剂,广泛用于光学纤维和纤维质透镜生产。铯的化学活性大,电离电位低,能改变主催化剂的表面性质,含铯的催化剂具有更好的催化活性、选择性和稳定性,可延长催化剂使用寿命,防止催化剂中毒。含铯的催化剂广泛用于氨合成,硫酸生产以及有机物的氧化、氢化、聚合、腈的形成等有机合成。铯盐具有镇静作用,可用于制造安眠药、镇静剂、癫痫治疗剂。137Cs作为放射性同位素标记用作诊断肿瘤,并正在取代60Co治疗癌症。氯化铯用于超速离心分离病毒、脱素核糖酸和其他大分子的密度-梯度介质。铯在冶金工业上被用作脱气剂和精炼剂。极易引起火灾。接触潮湿空气着火,与空气中的氧反应生成超氧化物,当混有有机物时,产生爆炸性的反应。与水或酸接触剧烈反应,并放出氢气引起燃烧。与卤素、硫黄和氧化剂接触剧烈反应。毒性比钠更强,但尚无因铯而引起中毒病例报道。铯主要对眼睛、皮肤和黏膜有强刺激性和腐蚀性。大鼠腹腔LD50:89 mg/kg。发生灼伤时,立即用水冲洗,伤口保洁,速送医院诊治。
化学性质
银白色有延展性的金属。相对密度1.892(18℃)。熔点28.44℃。沸点671℃。在潮湿空气中迅速氧化,能自燃着火。硬度0.2 Mohs。电阻率(0℃)19 μΩ?cm,(30℃)36.6μΩ?cm。比热容(20℃)0.217 J/(g?K)。熔化热2.087kJ/mol;汽化热68.85 kJ/mol。热导率:35.9 W/(m?K),在熔点时液体为18.4w/(m?K),在沸点时蒸气为0.0046w/(m?K)。与水反应释放出H2,溶于液氨。它是仅次于汞的易熔金属。铯的性质与钾相似,但比钾的反应性更强(碱金属中最活泼者)。与空气接触就着火,当混有有机物时就产生爆炸性反应。与水或酸类剧烈反应放出H2发生燃烧。有剧烈的反应性,有时有爆炸性用途
光电元件。聚合反应的催化剂。红外线灯。原子钟。用途
广泛用于电子工业、玻璃陶瓷工业、医药和冶金工业用途
是制造真空件器、光电管等的重要材料,化学上用做催化剂。生产方法
真空蒸馏法提纯 首先用扩散泵把装置抽成真空,将整个装置从A至E加热至400~450℃,使其干燥数小时。然后把提纯的氩气充满整个装置,切开A处,将装有带挥发油的金属铯的容器送人管B中,待挥发油蒸发后,把管B再次封住,将装置抽成真空(≤10-6托),用电炉在E附近进行加热,使铯在管D蒸馏析出。靠装置旋转,使熔融的铯从管D流到安瓿中,冷却后,装置充满氩气,将安瓿熔融物切断,制得高纯铯。类别
遇水燃烧物品毒性分级
中毒急性毒性
腹腔- 小鼠 LD50: 1700 毫克/ 公斤爆炸物危险特性
遇水、湿空气、氧化剂放出氢气可爆可燃性危险特性
遇水、湿空气放出氢气可燃储运特性
库房通风低温干燥;没于烃中保存; 与氧化剂、卤素、强酸分开存放灭火剂
干粉、干砂、干石粉安全信息
| 危险品标志 | Xi,C,F |
|---|---|
| 危险类别码 | 36/38-34-14/15-11 |
| 安全说明 | 26-45-43-36/37/39-16-8 |
| 危险品运输编号 | UN 3264 8/PG 3 |
| WGK Germany | 3 |
| RTECS号 | FK9225000 |
| F | 10 |
| TSCA | Yes |
| 危险等级 | 4.3 |
| 包装类别 | I |
| 海关编码 | 28051990 |
| 毒害物质数据 | 7440-46-2(Hazardous Substances Data) |
| 提供商 | 语言 |
|---|---|
|
中文
|
|
|
英文
|
|
|
英文
|
|
|
中文
|
|
|
英文
|
