环己醇是一种用途广泛的工业原料,具有醇类的一般性质,属脂环醇,有近似樟脑和杂醇油的气味,常用作树脂、油漆、乙基纤维素、橡胶等的溶剂;还用作清洁剂、橡胶增固剂等。可经呼吸道、消化道和皮肤吸收。高浓度蒸气可引起麻醉作用和对眼、鼻、咽喉部的刺激。皮肤接触可引起皮炎,重者可发生溃疡、坏死。预防措施为加强密闭、通风、防止皮肤污染。车间空气中最高容许浓度为50mg/m3。
【化学性质】
环己醇又称安醇、六氢化苯酚、六氢化酚。1894年德国贝尔医药首先制得。无色透明的粘稠液体。有近似樟脑和杂醇油的气味。有吸湿性。易燃。相对分子质量 100.16。相对密度0.9624。熔点 25.15℃。沸点161.1℃、103.7℃ (1.33×104Pa)。闪点67.2℃。折射率1.4641。蒸气压:1.07×102Pa (20℃)、2.00×102Pa(70℃)、3.60× 103Pa(80℃)、1.04×104Pa(100℃)、2.49×104Pa (120℃)、5.31×104Pa(140℃)、7.39×104Pa (150℃)。溶于水(20℃时3.6),与乙醇、乙醚、丙酮、氯仿、苯、二硫化碳、乙酸乙酯、亚麻子油等大多数有机溶剂可以互溶。与水形成共沸混合物,本品含量 21%,共沸点97.9℃。本品具有二级醇的一般通性。催化脱氢,生成环己酮。在镍(或铂)催化剂作用下,400℃脱氢,生成苯酚。在强氧化剂(如高锰酸钾)作用下,可生成己二酸。用硝酸氧化,也可制得己二酸。在三氧化二铝作用下,在300~400℃时,本品蒸气脱水,可生成环己烯。在碱性条件下,二分子本品缩合,生成环己基环己醇。蒸气有麻醉性。大鼠经口LD502060 mg/kg。工作场所最高允许浓度200mg/m3。
【环己醇的用途】
1,环己醇是一种用途广泛的高沸点溶剂(用作漆、清漆、涂料的溶剂,可改善流动性,提高平滑性,防止涂膜喷霜);水溶性乳胶的稳定剂;合成原料(生产己二酸及己内酰胺,聚合用单体、增塑剂、PVC等树脂稳定剂);杀虫剂和除草剂的原料;石油加工助剂;橡胶添加剂;医药品、化妆品(消毒皂、干洗剂)、染料的原料;也用作皮革脱脂剂、毛皮洗涤剂,金属洗涤剂及擦亮剂;纺织助剂(纤维整理剂)等。
2,由氧化铝等催化加热脱水得环己烯,由氧化剂作用可得环己酮或己二酸,在425℃与少量水蒸气一起通过铜锰催化剂可得苯酚,与三氯化铝于蒸汽浴上加热得氯代环己烷及少量环己烯,与氯、氯磺酸和三氯化铁在发烟硫酸中于130℃加热得到四氯苯醌。
3,作醇酸树脂、醇溶性酚醛树脂及乙基纤维素的溶剂,并可用于制赛璐珞、杀虫剂。
4,主要用于生产己二酸、己内酰胺、硝化纤维素油漆、尼龙66、尼龙6、增塑剂、消毒剂、杀虫剂、杀菌剂、纤维整理剂等。亦用作油漆、虫胶、清漆、橡胶、树脂和染料等的溶剂,皮革脱脂剂、干洗剂等,肥皂及合成洗涤剂乳液的稳定剂等。
【毒性】
环己醇主要中毒作用为中枢神经麻醉性与粘膜刺激性,亦可由皮肤吸收引起中毒。对脑、心、肺、肝、肾及脾等引起血管障碍。大鼠口投LD502060mg/kg,对人体发生粘膜刺激症状的最小中毒浓度为75ppm。在体内大部分与硫酸或葡萄糖醛酸结合,可从尿中排泄。最高容许浓度:作业环境空气中美国规定为50ppm (200mg/m3),日本为25ppm (102mg/m3);大气质量标准苏联、南斯拉夫和保加利亚规定为0.015ppm(0.06mg/m3,30分钟或24小时)。
【制备方法】
实验室由环己烯经硼氢化-氧化反应制备,化学反应路线图如下:
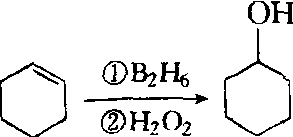
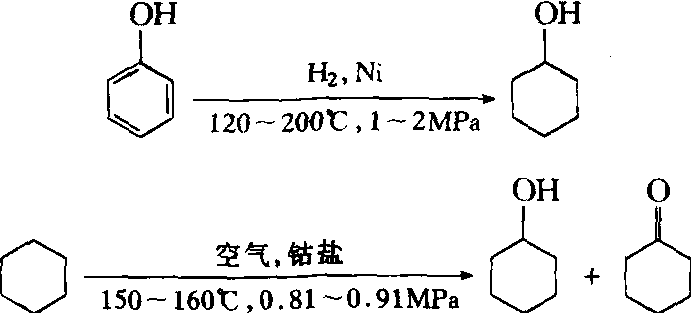
工业上用苯酚加氢或环己烷氧化制备,化学反应路线图如下:
1,以环己烷为原料,以环烷酸的钴(或铜)盐,或油酸的钴(或铜)盐为催化剂,进行空气氧化,可同时制得环己醇及环己酮,然后分离精制。
2,将环己酮还原。
3,用铜镍催化剂进行酚的加氢还原。
4,以环己烷为原料,在压力1.47~1.96MPa及温度170~200℃下,直接用空气氧化,经浓缩后,再用钼、钒、钴氧化物为催化剂,使之分解,可得环己醇及环己酮,再分馏精制。
5,以环己烷为原料,在150~170℃及 0.9~1.2MPa压力下与硼酸反应,然后水解,可生成粗制环己醇,分离后,蒸馏精制。
6,由环己烯与70%~80%硫酸反应,或环己酮在碱性介质中由铂、硅胶催化氢化,或于140~150℃由镍作催化剂气相氢化,也可由苯酚催化加氢而得环己醇。
【网络知识参考】
环己醇是一种仲醇,由一个羟基取代环己烷的其中一个氢而成,它也是苯酚与氢加成的产物。可发生消去反应生成环己烯,可被铬酸氧化为环己酮。
【苯酚加氢法】
1906年,Β.Н.伊帕季耶夫通过苯酚加氢制得环己醇,并在德国巴登苯胺纯碱公司首先实现工业化。苯酚加氢一般采用镍催化剂。反应温度150℃、压力2.5MPa,产率接近理论值,产品纯度高,反应平稳。进入60年代,鉴于原料价格的因素,环己烷氧化法逐步取代了苯酚加氢法。
【环己烷氧化法】
环己烷氧化反应比较复杂,它首先生成环己基过氧化氢,然后分解为环己醇和环己酮。各反应过程的速度常数比:k1/k2=3.7;k3/k4=1.4;k3/k1=24;k4/k2=66。这些比值几乎不受温度影响。它表明:
①环己醇和环己酮比环己烷更容易氧化;
②大部分环己酮是由环己醇氧化生成,环己酮又会生成各种氧化副产物。反应可在催化剂存在下进行,也可不用催化剂。常用的催化剂有:钴盐(环烷酸钴、油酸钴等)和硼酸,用钴盐催化剂 时,所得酮醇混合物(俗称酮醇油即KA油)之酮醇比为1:1~2,硼酸催化时则1:9,但需增设硼酸回收系统。不用催化剂的工艺,则设有环己基过氧化氢的催化分解系统。工业上应用最广泛的是钴盐法。
含有100ppm环烷酸钴的新鲜环己烷与循环环己烷混合,在三级串联的反应器中用空气氧化,温度150~160℃、压力 0.8~1.0MPa、反应时间 10~15min、单程转化率4%~6%。反应尾气经冷凝回收其中的环己烷和高沸物后放空。液相氧化产物经过碱洗皂化和水洗除去杂质后,蒸馏回收其中90%以上的环己烷,循环使用。在进一步脱除轻重组分后,便可获得醇酮混合物,经过精馏,便分离出环己醇和环己酮。
参考资料
http://baike.baidu.com/view/123395.htm
http://zh.wikipedia.org/wiki/%E7%92%B0%E5%B7%B1%E9%86%87
顾翼东 主编.化学词典.上海:上海辞书出版社.1989.第466页.
马世昌 主编.化学物质辞典.西安:陕西科学技术出版社.1999.第421页.
安家驹 主编;包文滁,王伯英,李顺平 合编.实用精细化工辞典.北京:中国轻工业出版社.2000.第611-612页.