嵌段共聚物是近年来出现的一类重要的多相体系,作为一种性质良好的高分子材料已引起物理学家、化学家和生物学家的极大关注,被广泛应用于医药、建筑和化工等行业。嵌段共聚物(Block Copolymers)是由化学结构和理化性质不同的两种或两种以上的大分子通过头尾连接所形成的共聚物,构成嵌段共聚物的每一段聚合物,都可以称之为一个“嵌段”(block)。基于不同聚合物嵌段的亲水性、溶解性和物理化学性质的内在差异,嵌段共聚物能够形成多种微结构。
嵌段共聚物的合成、组成、特性
嵌段共聚物的快速发展与新型聚合技术的开发密切相关。嵌段共聚物通常可以通过以下方式获得:(a)顺序可控或活性聚合,(b)简单偶联反应,(c)使用由2个不同起始片段组成的双引发剂,(d)包含功能切换的大分子引发剂等。值得注意的是,有时仅通过单一聚合技术无法合成某些特定结构的共聚物,此时,应该将多种聚合方法相结合,进行全面筛选,可以显著提高成功率。
用A、B、C来表示嵌段共聚物中链段,一般嵌段共聚物可表示为A-B型两嵌段共聚物、A-B-C型或A-B-A型三嵌段共聚物、-(-A-B-)n-型多嵌段共聚物、环型嵌段共聚物和星状接枝共聚物等。
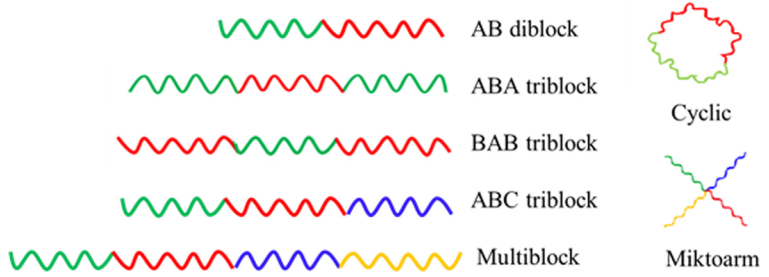
嵌段共聚物的组成类型
PEG是一种无毒、亲水、非免疫原性的聚合物,具有良好的生物相容性,为FDA批准使用的非离子型聚醚,其羟基端基为弱氢键酸,主链中含弱碱性醚键。可以通过多种方法将PEG分子添加到药物递送载体中,包括共价键合,制备过程中的共混或表面吸附,同时可以在任一端基上对PEG进行修饰以使其与其他分子或聚合物连接。PEG最初被引入只要领域,主要是其能有效地减少或避免与免疫球蛋白作用,阻碍载体与吞噬细胞黏合,从而延长药物在体内循环时间,减少药物在到达靶点前的损失,减轻全身毒副作用,此外,由于其亲水性、线性、柔性、不带电荷,以及易获得狭窄的质量分数分布,因此常被用于开发嵌段共聚物。
目前,随着高分子材料的发展,人们越来越青睐于一些可降解的高分子载体材料,因为它不会在体内积聚,也不会对环境造成影响,且很容易在人体内代谢和排泄,因此在生物医学或药物释放领域显示出诱人的应用前景。生物可降解材料不再局限于药物、多肽和蛋白质的定点靶向,在医疗器械和伤口敷料中也越来越重要。为了满足这些要求,生物可降解嵌段共聚物被认为是一种很有前途的生物材料,因为它们可以通过改变嵌段的组成比例或添加新的期望性能的嵌段来改变它们的两亲性、物理和力学性能。
与小分子表面活性剂相似,在水中,嵌段共聚物分子在低浓度时以单体形式存在;当浓度增加至临界胶束(CMC)浓度后,由于疏水作用、静电作用、氢键等分子间作用力,疏水区相互吸引,缔合在一起,形成胶束。聚合物胶束是被广泛研究的递送方式之一,其外壳最大限度地减少了调理作用,而内核则解决药物溶解问题,这是药物递送的先决条件。疏水性药物的水溶性差,限制了高通量筛选的成功率。这给科研人员的制剂工作带来了挑战,尤其是考虑到已批准的高分子量、高熔点、高亲脂性的药物分子越来越多,传统的脂类制剂增溶方法存在着药物在体内吸收前快速沉淀的问题。相反,胶束表现出优越的热力学稳定性和生物相容性。
嵌段共聚物在药物递送系统中的应用
在药物递送系统中,载体的选择至关重要,而嵌段共聚物胶束作为一种优质的高分子材料,凭借其独特的优势受到了学术界和产业界的广泛关注。通过对前人大量研究工作的深入学习与总结,选择嵌段共聚物胶束作为药物输送载体,具有以下优势:(1) 有多种不同类型的合成或天然聚合物可用于形成嵌段共聚物,制备方法简单,且不会对环境造成污染;(2)嵌段共聚物胶束具有较高的结构稳定性,其结构已知且较窄的尺寸分布也给递送体系的设计带来方便;(3)共聚物在溶液中不相容嵌段相分离形成胶束的内核和外壳。药物包埋在内核,溶剂化了的外壳阻止疏水内核的相互作用。大大增加了载药量,使体系有效的给药;(4)嵌段共聚物胶束尺寸一般为10~100nm,这个尺寸可以保障在血流中长程循环的实现;(5)嵌段共聚物可以把药物通过化学键键合到共聚物疏水部分,也可以利用各种相互作用使药物包埋在胶束内;(6)无需化学修饰实现高载药率。

两亲性嵌段共聚物的各种自组装
近年来,对聚乳酸(PLA)、聚乙丙酯(PCL)及其与聚乙二醇(PEG)的嵌段共聚物研究很多,这些聚合物都表现出一定的溶蚀降解特性,结晶度低的降解较快,最终降解成水和CO2,而且中间体乳酸也是体内的正常代谢物。PLA-PEG、PCL-PEG嵌段共聚物中,PLA、PCL是疏水段,而PEG是亲水段,调节两者的比例及共聚物的相对分子质量可控制其降解性能,从而控制微球中药物的释放速率。
在癌症治疗方面,传统化疗法缺乏对肿瘤细胞的特异性和靶向性,因此常常出现损害健康细胞或产生耐药性的情况。此外,抗癌药物的低水溶性也是药物设计中的一个制约因素。嵌段共聚物具有良好的自组装特性和较高的载药效率,可以避免这一问题。可调的物理化学性质和进一步的官能团化为制剂开发提供了非常有前途的辅料。嵌段共聚胶束通过增强渗透性和保留性在目标部位进行被动分布和保留,促进大分子或微粒的运输和定位,以减少对健康细胞的暴露和损害。因此,嵌段共聚物因其热力学稳定、生物相容性好、毒性小,在药物输送和靶向治疗方面备受青睐。然而,由于血管系统的不均匀性,导致药物分布不均匀,但是嵌段共聚物的分子链有着丰富的可设计性, 如各嵌段的化学组成、两亲比例及共聚物相对分子质量等, 通过对聚合物骨架进行化学修饰,进而提高载体与靶细胞的选择性和亲和力。
嵌段共聚胶束将亲脂性药物包裹在其疏水微环境核心中,提高了其溶解性和生物利用度。这种自组装是由亲水性和疏水性嵌段之间的水溶性差异驱动的,随着温度的升高,缔合数逐渐增加,从而推断出胶束的各向异性生长或结构转变。研究还表明,混合胶束的方法通常将两种具有不同亲水-亲油平衡值的嵌段共聚物结合在一起,以增强药物的包封性和稳定性。
总之, 基于嵌段共聚物的药物递送系统在提高治疗效率和最大限度减少毒副作用方面具有巨大的潜力。此外,它们的自组装行为在医学、生命、生物技术和环境领域都非常重要,有望发挥意想不到的应用价值。
参考文献:
- Kuperkar, K., Tiwari, S., and Bahadur, P. Self-Assembled Block Copolymer Nanoaggregates for Drug Delivery Applications. Applications of Polymers in Drug Delivery, 2021, 423–447. 10.1016/B978-0-12-819659-5.00015-X
- Raval, N., Kalyane, D., Maheshwari, R., and Tekade, R. K. Copolymers and Block Copolymers in Drug Delivery and Therapy. Basic Fundamentals of Drug Delivery, 2019, 173–201. 10.1016/B978-0-12-817909-3.00005-4
- Giram, P. S., Wang, J. T.-W., Walters, A. A., Rade, P. P., Akhtar, M., Han, S., … Al-Jamal, K. T. Green synthesis of methoxy-poly(ethylene glycol)-block-poly(l-lactide-co-glycolide) copolymer using zinc proline as a biocompatible initiator for irinotecan delivery to colon cancer in vivo. Biomaterials Science. 2020. 10.1039/d0bm01421d