当我们在准备开展一个流式实验时,有没有想到流式样本的保存有时反而会大大影响到最终的实验结果呢?今天罗工就流式样本的保存来给大家聊聊这方面的经验和分享。
首先,我们最常见的流式样本就是各种外周血了,最早的流式应用也是检测人外周血中的CD4等一系列的水平,从而发展为今天各类各样的流式实验的。针对人的外周血,临床上一般会使用多种多样的各类采血管进行收集,而能用于流式实验的,往往是2类抗凝采血管:EDTA抗凝管和肝素钠抗凝管。
EDTA抗凝管

肝素抗凝管
对于一般的流式实验,我们使用edta抗凝管即可,edta抗凝管保存的血样我们放置于常温或者4度都可以有效保存细胞长达24甚至是72h之久;但是,对于一些特殊的流式实验,例如,我要检测AnnexinV的凋亡,或者检测IFN,IL-4.IL-17等分泌型细胞因子,此时就应该选择肝素钠抗凝的采血管。因为上述这些实验内容都会因为EDTA的存在使实验结果受到比较大的影响。
其次,当我们的样本是各类组织,或者肿瘤样本时,我们在取出样本到处理为单细胞悬液的这段时间里,样本如果保存不当也会影响后续的细胞活性和表型,此时我们的样本应该优先浸泡在培养基或者组织保存液中等待处理,而不是简单的放在pbs或者生理盐水中,且浸泡一定要保证浸泡全部组织。
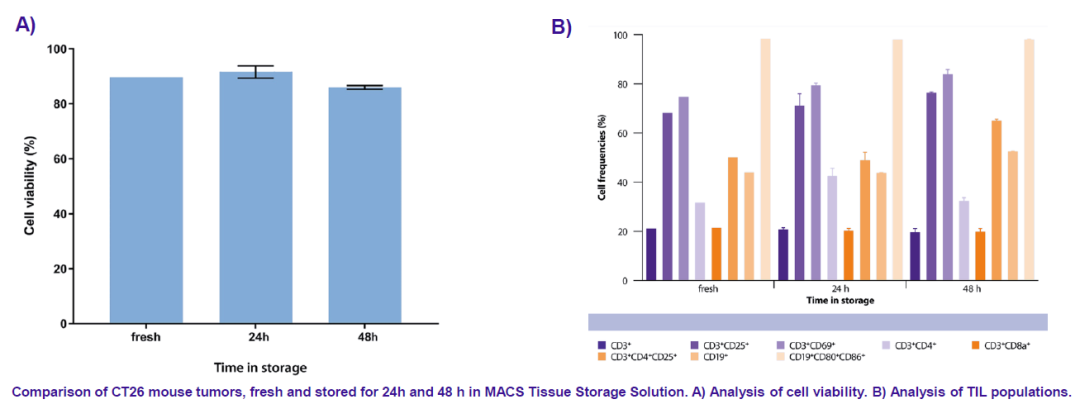
相比PBS和生理盐水,商品化的组织保存液(美天旎公司)会更加有效的保证后续流式分析时的细胞活力和亚群细胞比例稳定。
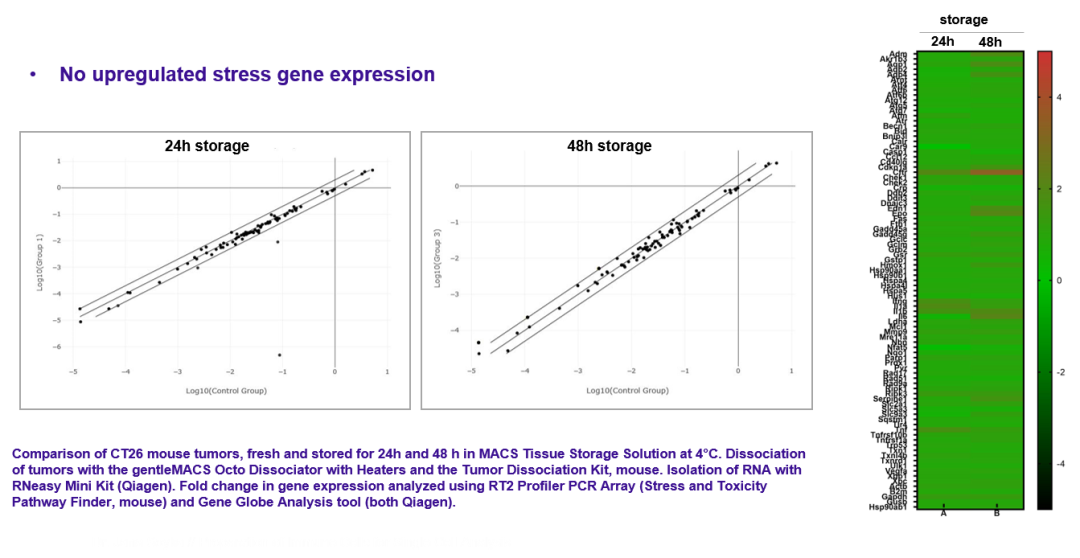
对细胞应激相关的蛋白转录谱进行研究,使用组织保存液保存的样本不引起细胞应激相关通路的改变,提示组织内细胞状态得到很好的维持。
最后,当我们把流式样本处理好并进行流式抗体标记后,这些样本也应该尽快的进行上机检测分析,否则时间一长也会影响到我们的实验结果。如果我们不能马上分析我们处理染色好的单细胞样本,应该如何操作呢?
如果我们不能及时的上机检测,可以将已经染色好的细胞在1-4%的多聚甲醛(或者BD的cytofix buffer)中4度固定20-30分钟,然后加入1ml的pbs/staining buffer离心清洗细胞,最后保存于PBS/staining buffer中4度避光即可。此时的样本经过固定可以至少保证72h内的上机效果,甚至曾经有老师1周后上机效果仍然可以。
但是在这里有2个误区大家一定要清楚:
1. 样本固定后不能一直泡在多聚甲醛固定液里,一直浸泡会导致大量的荧光抗体的荧光淬灭,例如FITC,BV510等都对多聚甲醛非常敏感,一定要固定后及时洗脱。
2. 如果您的流式实验本身就有固定/破膜的实验步骤并且能确保24h-48h内上机的,根据我们的经验无需进行再次固定这个步骤,当然如果不能,是再固定一次,以稳定胞内抗体和样本蛋白的结合。
上海优宁维生物科技股份有限公司
试剂 | 耗材 | 仪器 | 软件 | 定制 | 实验服务 | 供应链
免费热线:4008-168-068
咨询邮箱:info@univ-bio.com
订购商城:优宁维商城
微信公众平台:优宁维抗体专家,欢迎关注!
小优博士(小程序):5大课堂, 让你的科研不再难!

