癌症是严重威胁人类健康的疾病之一。根据国家癌症中心发布的《2021中国癌症报告》,2021年,全国恶性肿瘤新发病例数380.4万例,相当于平均每天超过1万人被确诊为癌症,每分钟有7个人被确诊为癌症。正常情况下,免疫系统可以识别并清除肿瘤微环境中的肿瘤细胞,但为了生存和生长,肿瘤细胞能够采用不同策略,使人体的免疫系统受到抑制,不能正常的杀伤肿瘤细胞,从而在抗肿瘤免疫应答的各阶段得以幸存,这种被称为免疫逃逸。
T细胞在杀伤癌细胞中起着关键作用,而癌细胞通过表达细胞程序性死亡-配体1(PD-L1)表现出免疫逃逸,豁免了T细胞的杀伤作用。PD-L1与程序性死亡蛋白1(PD-1)的结合抑制T细胞增殖和活性,导致肿瘤免疫抑制。免疫检查点抑制剂(Immune-checkpoint inhibitors,ICIs)通过阻断PD-L1/PD-1的结合,从而达到肿瘤治疗的目的。
总之,在肿瘤免疫中,免疫检查点PD1及其配体PDL1作为协同物,帮助肿瘤抵抗免疫诱导的细胞凋亡,促进肿瘤进展。针对PD1/PDL1的免疫治疗可有效阻断其促肿瘤活性。Anti-PD1/PDL1治疗在过去的十年中取得了巨大的成功,目前研究最多,临床发展最快的一种免疫疗法。
CD8 T细胞由于具有直接的抗肿瘤细胞毒效应功能,已成为抗肿瘤免疫研究的核心。CD8+ T细胞识别呈递于MHC I类上的肿瘤抗原后激活,释放IFN-γ与IFN-γ受体结合,进而诱导肿瘤细胞上PDL1的表达。PDL1结合T细胞表面升高的PD1,触发PD1/PDL1轴抑制作用。Anti-PD1或anti-PDL1抗体阻断PD1与PDL1的相互作用,消除CD8+T细胞的抑制作用,从而增强抗肿瘤活性。
与此同时,免疫检查点阻断(immune checkpoint blockade,ICB)的临床成功引起了人们对了解T细胞耗竭作为开发更有效的免疫疗法组合和识别反应的生物标志物的兴趣。肿瘤患者T细胞耗竭的研究,主要集中在CD8T细胞,认为T细胞衰竭是肿瘤特异性和对ICB反应的标志。但与CD8细胞毒性T淋巴细胞耗竭相反,CD4 T细胞耗竭仍然不被重视。那么,CD4T细胞在PD1阻断及整个肿瘤免疫过程中又在发挥何种功能呢?接下来的两篇文章跟大家一起看看。
1、PD-1对肿瘤浸润淋巴细胞活性的影响

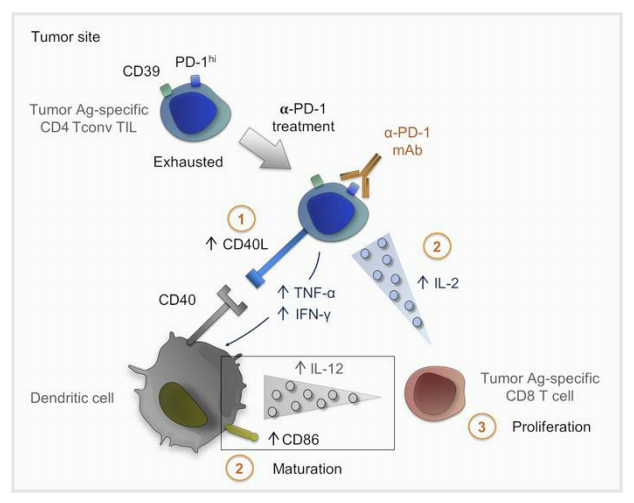
肿瘤抗原特异性CD4 T细胞在肿瘤部位聚集,提示其参与原位抗肿瘤效应功能。在这篇文章中,作者使用表型、转录组和功能方法,对头颈癌、宫颈癌和卵巢癌患者的CD4 T细胞衰竭进行了表征研究。研究发现一个CD4肿瘤浸润淋巴细胞(TIL)群体,由高表达的PD-1和CD39定义,其中包含高比例的细胞因子产生细胞,尽管这些细胞产生的细胞因子的数量很低,但是容易引起耗竭状态。与TIM-3的表达无关,CD4 TILs的末端衰竭被证实,提示CD8 T细胞衰竭引起分化。scRNA-Seq和进一步的表型分析揭示了其与CD8 T细胞耗竭程序的相似性。其中PD-1hiCD39+ CD4 TILs表达耗竭转录因子TOX和趋化因子CXCL13,具有肿瘤抗原特异性。在体外实验中,PD-1阻断后CD4 TIL活化增强,CD154表达和细胞因子分泌增加,促进树突状细胞成熟,从而提高肿瘤特异性CD8 T细胞增殖。研究结果表明,耗竭的CD4 TILs是免疫检查点封锁反应的参与者。
接下来,跟着小优一起看看具体的研究思路吧。
首先,作者先将发现的CD4 TILs进行表型分析将其定义为PD-1hiCD39+ CD4 TILs。
(1)耗竭的CD4 TIL群体的定义
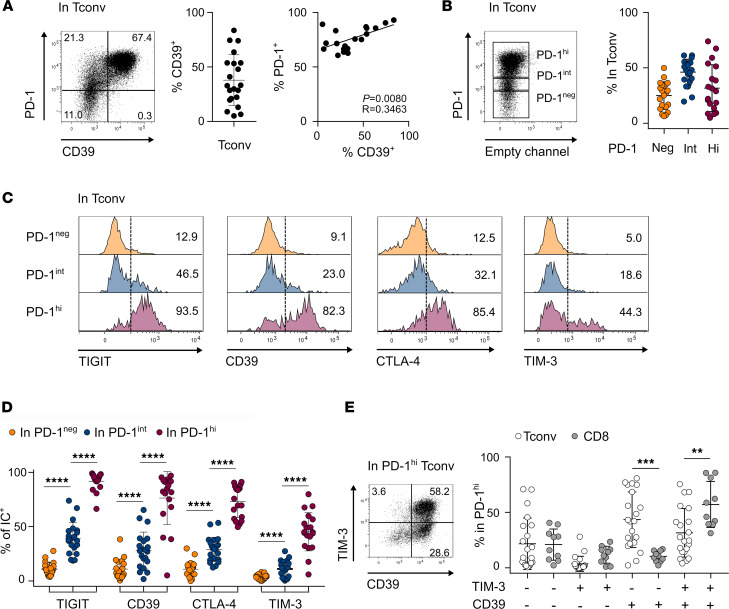
图2 CD4+ Tconv TILs 中CD39表达情况
将CD4+ and CD8+ TIL细胞体外染色并流式检测。平均37.9%的CD4 Tconv TILs表达CD39;所有CD39+细胞均高表达PD-1 (PD-1hi);CD39的表达与PD-1呈正相关(图2A)。由于PD-1高表达与耗竭相关,我们分析了PD-1neg、PD-1int和PD-1hi CD4 Tconv TIL中免疫检查点(ICs)(包括CD39)的表达(图2B)。PD-1hi群体中ICs的表达比例最高。大多数PD-1hi细胞表达TIGIT, CTLA-4, CD39,而TIM-3 +细胞的比例较低(图2C和D)。我们将CD8和CD4 Tconv TIL比较,在PD-1hi细胞中,CD39 细胞和TIM-3均表达。在PD-1hi CD4 Tconv组分中,CD39可单独或与TIM-3联合表达,而仅表达TIM-3的细胞很少被检测到(图2E)。相比之下,在CD8 PD-1hi细胞中,CD39和TIM-3系统性共表达(图2E)。
结论1:这些数据表明CD39和TIM-3在CD4和CD8 TILs之间的表达存在差异,提示CD39的表达可以识别耗竭的CD4 TILs,而不是TIM-3的表达。将这一细胞群定义为PD-1hiCD39+ CD4 TILs。
明确表型之后,作者进行scRNA-Seq来研究CD39+ CD4 TIL中的耗竭、肿瘤驻留和晚期分化特征。
(2)scRNA-Seq揭示CD39+ CD4 til中的衰竭、肿瘤驻留和晚期分化特征
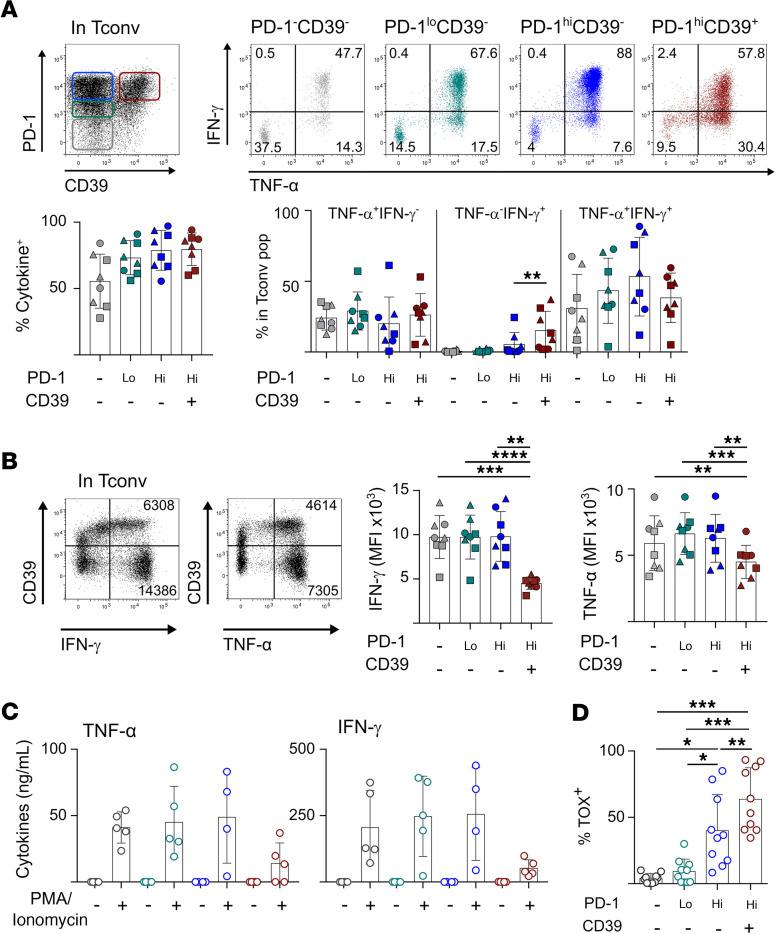
图3 PD-1hiCD39 +CD4 Tconv TILs功能衰竭
为了探讨CD39的表达在CD4 Tconv TILs中的功能影响,我们用PMA和离子霉素刺激CD4 TILs,并根据Tconv TIL亚群中IFN-γ和TNF-α的产生来评估PD-1和CD39表达,即PD-1–CD39–, PD-1loCD39–, PD-1hiCD39–和PD-1hiCD39+(图3A)。在PD-1hi细胞群中,CD39细胞含有高比例的多功能IFN-γ+TNF-α+细胞。它们在CD39+细胞中的比例较低,有利于IFN-γ单阳性细胞,表明末端衰竭(图3A)。对IFN-γ+和TNF+群体的分析表明,PD-1hiCD39+细胞中各自的MFI均低于其他所有群体(图3B),这表明这些细胞产生的细胞因子数量更少。根据PD-1hiCD39+细胞中TIM-3的表达情况,PD-1hiCD39+细胞及其MFI没有发生变化(图3,A和B)。与其他亚群相比,体外扩增的PD-1hiCD39+培养液在再刺激后产生的细胞因子量更低(图3C)。综上所述,这些结果表明CD39而不是TIM-3是CD4 Tconv TILs末端衰竭的标志。与这一假设一致,PD-1hiCD39+ CD4 Tconv TILs中CD8 T细胞衰竭转录因子TOX的表达最高(图3D)。
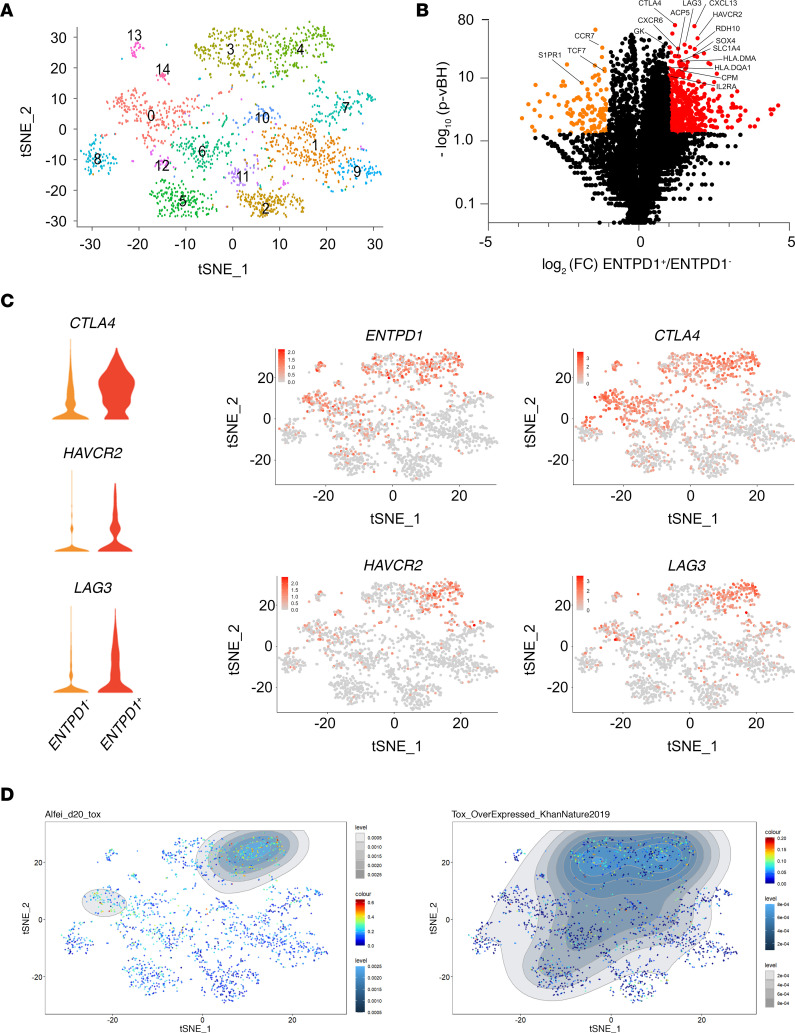
图4 CD4 TconvsTIL的scRNA-Seq
将从4个头颈部肿瘤标本中分离的CD45 +细胞进行了scRNA-Seq检测。结果表明:CD4 T细胞聚类鉴定出15个聚类(图4A)。在CD4 Tconv中,ENTPD1 (CD39)+和ENTPD1-之间的差异mRNA表达分析鉴定出291个差异表达基因(图4B)。在ICs中,CTLA4、HAVCR2和LAG3在ENTPD1+细胞中上调(图4C)。CTLA4与ENTPD1在同一簇中表达,而HAVCR2 (TIM-3)仅在ENTPD1+细胞的亚群中表达(图4C),印证流式数据结果,在与HAVCR2相同的簇中检测到LAG3的表达(图4C)。最后,与PD-1hiCD39+ CD4 TILs中TOX的表达一致(图3D),由Alfei等人和Khan等人在T细胞与TOX编码的逆转录病毒转导后鉴定可知, ENTPD1+群过表达TOX转录组特征(图4D)。
结论:经高表达PD-1和CD39定义的耗竭的CD4 TIL具有相同的CD8 T细胞耗竭程序特征。值得注意的是,与之前的报道一致,CD39或ICs和CD73在人类CD4 T细胞中的表达没有重叠,作者在Tconv TILs中没有检测到NT5E (CD73)的表达。
(3)PD-1hiCD39+ CD4 Tconv TILs包含肿瘤特异性细胞(Ag),并在PD-1阻断时对CD8 T细胞提供帮助
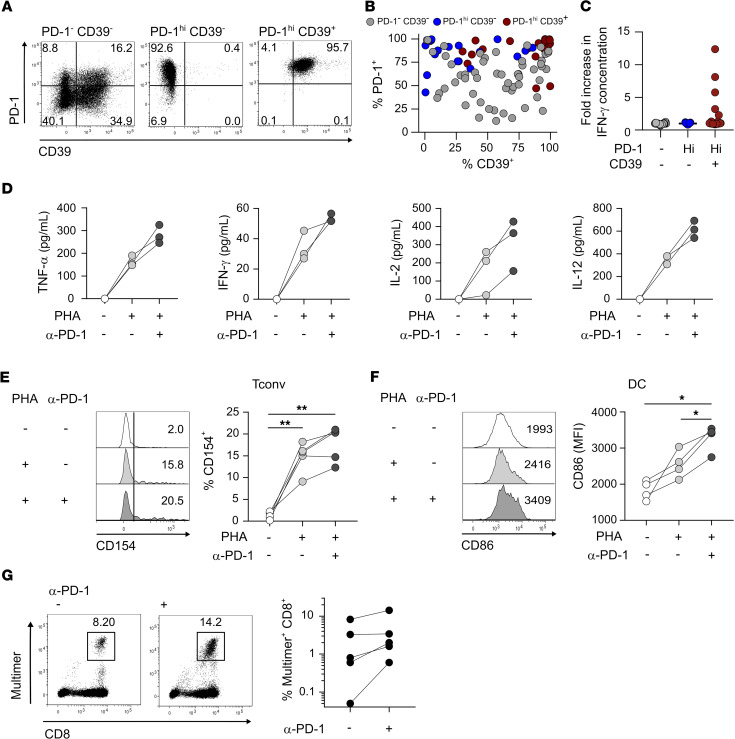
图5 PD-1hiCD39+ CD4 Tconv TILs包含肿瘤特异性细胞,并通过增强DC介导的CD8 T细胞增殖来响应PD-1的阻断
作者将体外CD4 Tconv TILs分类为PD-1-CD39-、PD-1hiCD39-和PD-1hiCD39+亚群(图3A)并克隆。在体外扩增的PD-1hiCD39-和PD-1hiCD39+亚群的克隆群体中,绝大部分保守了它们的体外表型(图5,A和B)。一部分来自分类后的PD-1-CD39-细胞的克隆获得了一定水平的PD-1和/或CD39表达(图5,A和B)。作者用覆盖全长NY-ESO-1的重叠肽池来刺激所有克隆体。来自PD-1hiCD39+亚群的22个克隆中,有5个在Ag刺激下特异性分泌IFN-γ,而来自PD-1 CD39-和PD-1hiCD39-亚群的54个克隆和17个克隆分别没有表现出Ag识别(图5C)。
作者研究了阻断抗PD-1单克隆抗体是否可以直接影响耗竭的CD4 T细胞辅助活性。首先分析了PD-1阻断对CD4 Tconv TILs帮助DC成熟能力的影响。与未处理的CD4TIL共培养相比,经抗PD-1预处理的CD4/未成熟DC共培养中,CD4 T细胞和DC细胞的细胞因子分泌增加(图5D)。与这些结果一致的是,我们发现PD-1阻断CD4 TIL后CD154 (CD40L)的表达增强(图5E),这意味着通过CD40-CD40L相互作用诱导iDC成熟的能力增强。因此,CD4 TIL的抗PD-1预处理导致DC成熟增强,这可以从共刺激配体CD86的表达增加(图5F)以及IL-12分泌增加得到证明(图5D)。这些结果表明CD4 TIL可被抗PD-1单克隆抗体靶向作用,导致CD4 TIL活化介导DC成熟。
结论:结果表明,肿瘤部位耗竭的CD4 T细胞是PD-1封锁反应的参与者。作者发现与CD39表达相关的PD-1高表达,并作为CD4 T细胞原位耗竭的标志物。PD-1hiCD39 + CD4 T共享CD8 T耗竭特征,特别是,耗竭转录因子TOX的表达及其目标基因以及Ags。研究表明,尽管PD-1hiCD39 + CD4TIL中,细胞因子生成细胞比例高,但这些细胞产生的细胞因子的数量低于其他CD4 TIL亚群中细胞因子生成细胞产生的细胞因子数量,促进它们的耗竭状态。CD4 TILs中PD-1的阻断增加了细胞因子的产生以及刺激后CD154上调,导致DC的加速成熟。研究发现PD-1阻断特异性PD-1hiCD39+ CD4 TILs可以支持特异性自体CD8 T细胞的增殖,这意味着CD4 TILs在原位发挥辅助功能,而这可以通过PD-1阻断而增强。基于本文的结果和之前的研究工作,作者提出了一个模型,循环中的PD-1+肿瘤特异性CD8 T细胞到达肿瘤部位,在那里它们受到DC的刺激,增殖,获得Trm标记物并在局部保留,最终耗尽。在抗PD-1/PD-L1作用下,通过直接阻断PD-1对CD8 T细胞的作用,并通过重新激活肿瘤特异性CD4 T细胞的辅助活性,促进CD8 T细胞的增殖。
小优为您整理了部分相关产品哦~
样本制备
FICOLL PAQUE PLUS 6X100 ML
MACS Tissue Storage Solution
Tumor Dissociation Kit, human,
gentleMACS Octo Dissociator
MACS SmartStrainers (70 µm)
Red Blood Cell Lysis Buffer
磁珠分选
CD45 MicroBeads, human
MidiMACS Starting Kit (LS)
Mini&MidiMACS Starting Kit (MS, LS)
QuadroMACS Starting Kit (LS)
autoMACS Running Buffer 6 X 1,5L
MACS BSA Stock Solution 6 x 75 ml
autoMACS Rinsing Solution 6 x 1,45 L
流式检测
Hu CD3 PE UCHT1 100Tst
Hu CD4 Horizon V500 RPA-T4 100Tst
Hu CD39 BV650 TU66 100Tst
Hu CD45RA BUV737 HI100 100Tst
Hu/NHP CD69 APC-H7 FN50 50Tst
Hu CD86 PE 2331(FUN-1) 100Tst
Hu CD103 FITC Ber-ACT8 100Tst
Hu CD152 BV786 BNI3 50Tst
Hu CD279 (PD-1) BUV737 EH12.1 50Tst
Hu TIGIT BV650 741182 50ug
Hu TIM-3 (CD366) BV421 7D3 100Tst
TOX Antibody, anti-human/mouse, pure, REAfinity™
Hu IFN-γ Alexa 700 B27 100ug
Hu TNF PE-Cy7 MAb11 100Tst
Biotinylated Human HLA-A*0201 NY-ESO-1 (SLLMWITQC) complex Protein
Hu HLA-DR NALE L243 (G46-6) 500ug
Hu HLA-DP PE B7/21 100Tst
HLA-DQ Antibody (clone SPV-L3) LS-C390296
细胞因子检测
Hu IFN-γ ES CBA Flex Set B8 100Tst
Ms IL-2 ES CBA Flex Set A5 100Tst
Ms TNF ES CBA Flex Set C8 100Tst
Human TNF-α High Sensitivity ELISA Kit
Human IFN-γ High Sensitivity ELISA Kit
Human IL-4, premium grade
Human GM-CSF, premium grade
TexMACS GMP Medium - 1000mL (Phenol Red)
手术治疗、放疗、化疗和免疫治疗是目前肿瘤治疗的4大手段。研究表明,CD4 T和CD8 T均参与肿瘤的免疫治疗。而单一的放疗活免疫疗法得到的效果有限,为此,研究者们也想观察2种疗法结合起来的效果和机制。接下来跟大家分享的文章则从这个角度向大家展示了CD4 T和CD8 T结合疗法对肿瘤的控制。
2、CD8+和CD4+在肿瘤治疗中的作用

体细胞非同义突变产生的新抗原是肿瘤特异性T细胞的关键靶点,但只有少数预计具有免疫原性的突变是由MHC分子在癌细胞上呈现的。在小鼠和患者身上进行的疫苗接种研究表明,大多数引起T细胞反应的新表位不能诱导显著的抗肿瘤活性,原因尚不完全清楚。本篇文章结果表明,在免疫原性差的三阴性乳腺癌小鼠模型中,放疗可上调含有免疫原性突变的基因表达。由这些基因编码的新表位接种可诱导CD8+和CD4+ T细胞,虽然这些细胞对防止肿瘤生长无效,但却提高了放疗的疗效。机制上,新抗原特异性CD8+ T细胞优先杀死辐照过的肿瘤细胞。新抗原特异性CD4+ T细胞是疫苗治疗效果所必需的,其作用机制是产生Th1细胞因子,杀死被照射的肿瘤细胞,促进表位扩散。这种细胞毒活性依赖于辐射上调肿瘤细胞表面II类MHC分子以及死亡受体FAS/CD95和DR5的能力。研究结果表明:放疗与新抗原接种协同工作,以改善肿瘤控制。
在这里,作者使用4T1细胞,一种具有293体细胞突变的免疫原性差的三阴性乳腺癌小鼠模型,来测试放射治疗是否可以增加其编码免疫源性突变的基因表达。
(1)4T1肿瘤细胞中CD8+新表位的鉴定

图6 4T1乳腺癌细胞中放射治疗上调MHC-I新表位的预测和体外验证
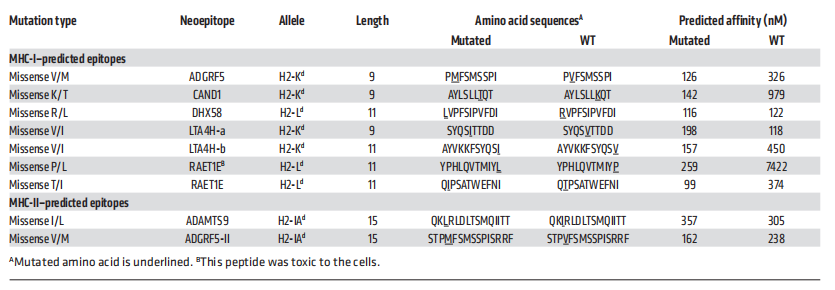
为了鉴定新抗原,首先在体外对4T1细胞进行了全外显子组和RNA测序。发现224个基因共包含293个体细胞突变,其中115个基因编码的154个突变在RNA水平上表达(图6A)。其中,97个突变通过了基于变异等位基因频率的附加筛选。通过对同基因BALB/c小鼠4T1肿瘤提取的DNA/RNA进行全外显子组/RNA测序,证实了11个突变基因(对应13个突变)在体内的表达。
接下来,为了验证辐射增加了编码免疫源性突变的基因表达的假设,作者比较了这11个突变基因在经辐照处理和未处理的4T1细胞中的表达。细胞经连续3天以8 Gy的剂量照射处理,4个基因Adgrf5、Cand1、Dhx58和Raet1e(包含5个突变),辐射显著上调(图6B)。利用NetMHC算法和pVAC-Seq新抗原发现系统,预测这4个基因中的9个新表位与MHC-I蛋白的亲和力小于300 nM,根据亲和力最高的评分,每个突变选择1个新表位进行检测(表1)。使用表达小鼠MHC-I等位基因H2-Kd或H2-Ld的RMA-S细胞进行稳定试验,检测相应多肽与MHC-I分子的结合(图6C)。CAND1与H2-Kd具有很强的结合能力,与作为阳性对照的表位HA515的结合能力相当。ADGRF5也与H2-Kd结合,但结合程度较低。对于H2-Ld, RAET1E和DHX58表现出较强的活性。结果表明,CAND1/H2-Kd和DHX58/H2-Ld配合物的半衰期最长(>6小时);ADGRF5/H2-Kd和RAET1E/H2-Ld配合物的半衰期最短(<6小时)(图6 D)。
表1 用于体外和体内试验的候选新表位的特征
(2)辐射可上调新表位的体内免疫原性
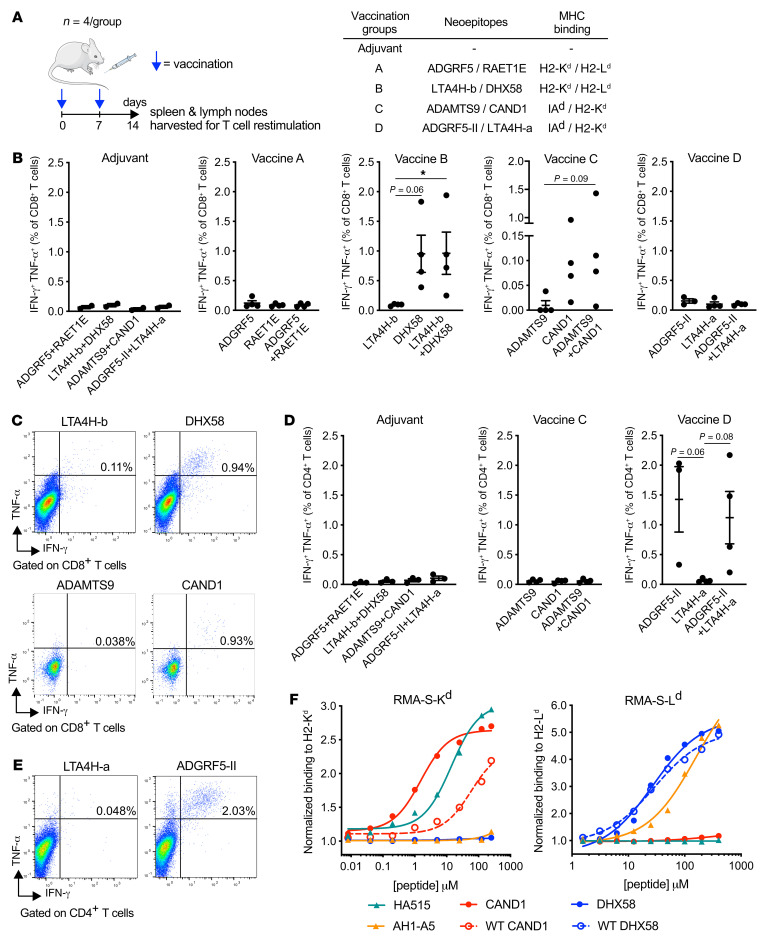
图7 4T1细胞中免疫原性新表位的鉴定
小鼠分别用佐剂或多肽联合免疫两次,间隔1周(图7A)。第二次免疫一周后,将免疫引流淋巴结和脾脏的细胞悬液与相应的新表位体外重新刺激,然后在CD8+和CD4+ T细胞内对参与T细胞效应功能的2种细胞因子IFN-γ和TNF-α进行细胞内染色。在CD8+新表位中,ADGRF5、RAET1E、LTA4H-a和LTA4H-b并没有在仅注射佐剂的小鼠中引起高于背景的反应(图7B)。相比之下,DHX58和CAND1刺激了多功能的CD8+ T细胞反应,大多数应答细胞同时产生IFN-γ和TNF-α(图7,B和C)。在CD4+新表位中,只有ADGRF5衍生的肽(以下为ADGRF5-II)刺激CD4+ T细胞产生IFN-γ和TNF-α。表明它能够在体内启动T细胞反应(图7,D和E)。对比突变和未突变(WT)多肽与MHC-I等位基因的结合能力,CAND1有显著差异(EC50分别为1.5 μM和58.4 μM), DHX58差异不显著(EC50分别为27.0 μM和29.2 μM)(图7 F)。
(3)CAND1新表位是CD8+细胞毒性T细胞的靶点
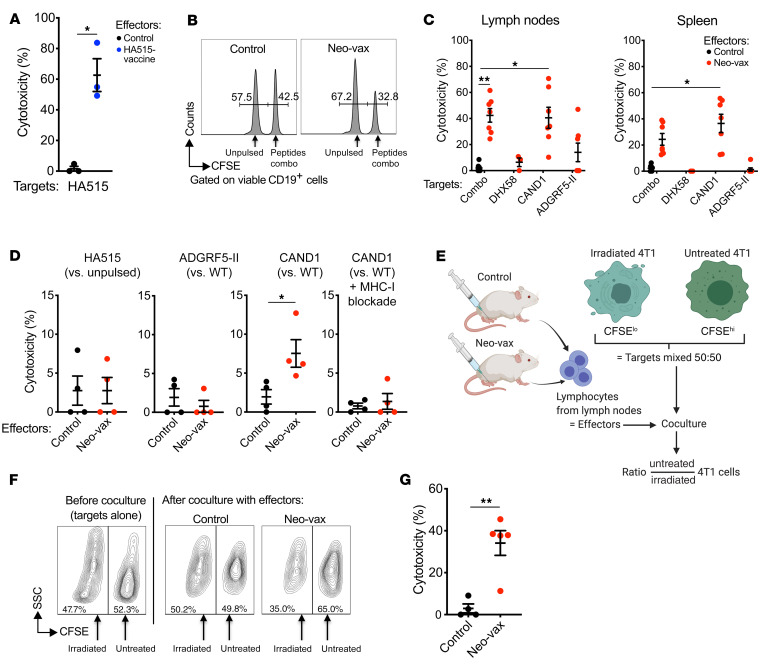
图8 CAND1特异性的CD8+ T细胞具有细胞毒性,并能优先杀死辐照过的4T1细胞
接种了HA515多肽的小鼠作为实验的阳性对照,显示出对载HA515靶细胞的高体内细胞毒活性(图8A)。在接种Neo-vax的小鼠中,体内细胞毒性对装载所有3种多肽的细胞和仅装载CAND1的细胞在脾脏和淋巴结中都是显著的,表明这个新表位是细胞毒性T细胞的主要靶点(图8,B和C)。对DHX58新表位没有检测到细胞毒性。同样,在体内或体外对装载ADGRF5-II的靶细胞也没有显著的细胞毒性(图8,C和D)。相反,在体外,Neo-vax处理的小鼠淋巴结衍生的T细胞容易杀死带有cand1突变的靶细胞,但没有WT表位。细胞毒性在MHC-I阻断抗体的存在下消失,证实了CD8+ T细胞对MHC-I呈现突变肽的特异性(图8D)。接下来,从Neo-vax或仅佐剂接种的(对照)小鼠中分离出的T细胞分别与未经处理和用高剂量和低剂量CFSE标记的4T1靶细胞孵育(图8E),与Neo-vax小鼠的淋巴结细胞共培养后,可以观察到辐射4T1细胞与未辐射4T1细胞的选择性杀伤(图8,F和G)。这些数据表明,Neo-vax疫苗可产生针对CAND1新抗原的CD8+细胞毒T细胞,可以选择性地杀死辐。
(4)照射后癌细胞上CAND1和ADGRF5-II新抗原表位增加
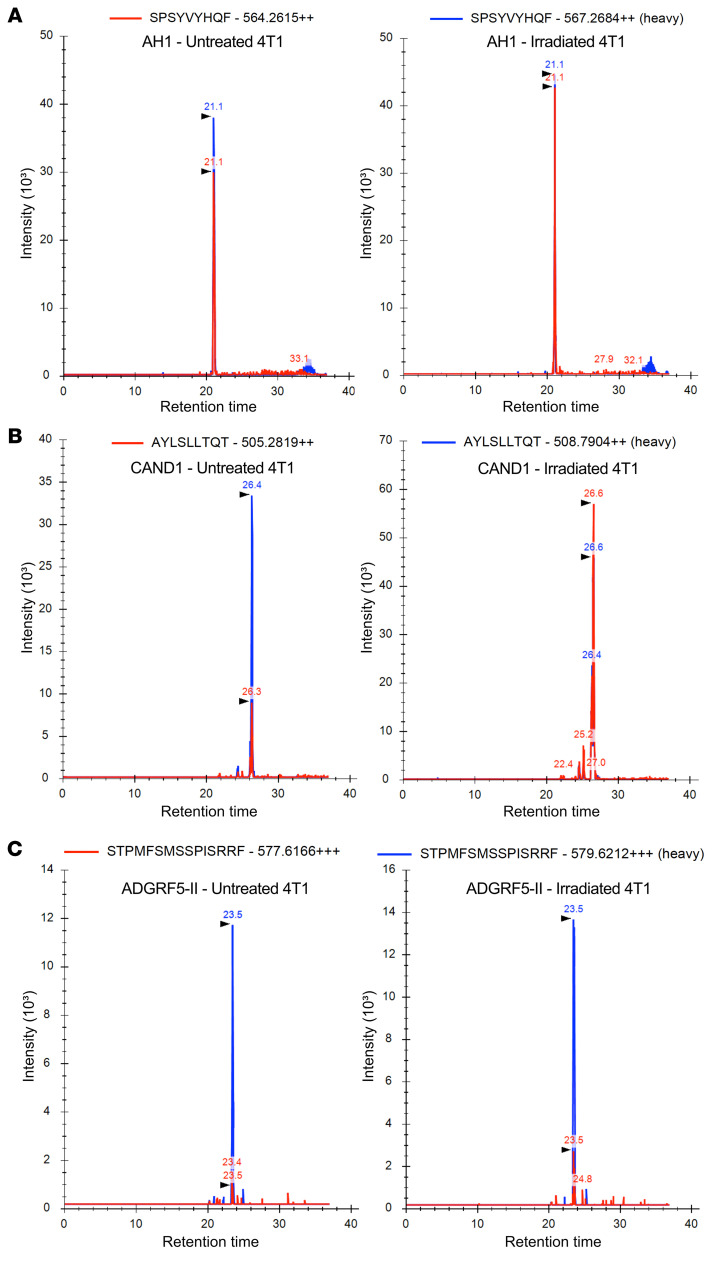
图9 靶向检测和定量照射后肿瘤细胞表面的新表位和控制表位AH1
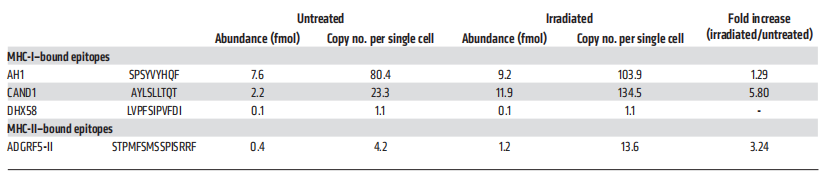
从未经处理和辐照处理的4T1细胞中免疫纯化MHC-I和MHC-II复合物,洗脱MHC结合肽后,样本中掺入重同位素标记标准肽进一步定量目标SRM分析(图9)。控制AH1肽是识别和量化与拷贝数略有增加/单细胞辐照4T1细胞(103.9)比未经处理的细胞(80.4;图9A和表2)。相比之下,CAND1表达非常低拷贝数/单细胞在未经处理的细胞(23.3),但丰富辐照后显著增加(134.5)(图9B和表2)。尽管在未处理的4T1细胞上几乎检测不到MHC-II分子的表达,但通过靶向MS分析,MHC-II结合的ADGRF5-II肽被识别出来,在辐照的4T1细胞中,每个细胞的拷贝数至少增加了3倍(图9C和表2)。
表2 未处理和辐照4T1细胞中(neo)抗原表位的定量
(5)接种辐射上调的新抗原可改善放疗对肿瘤的控制
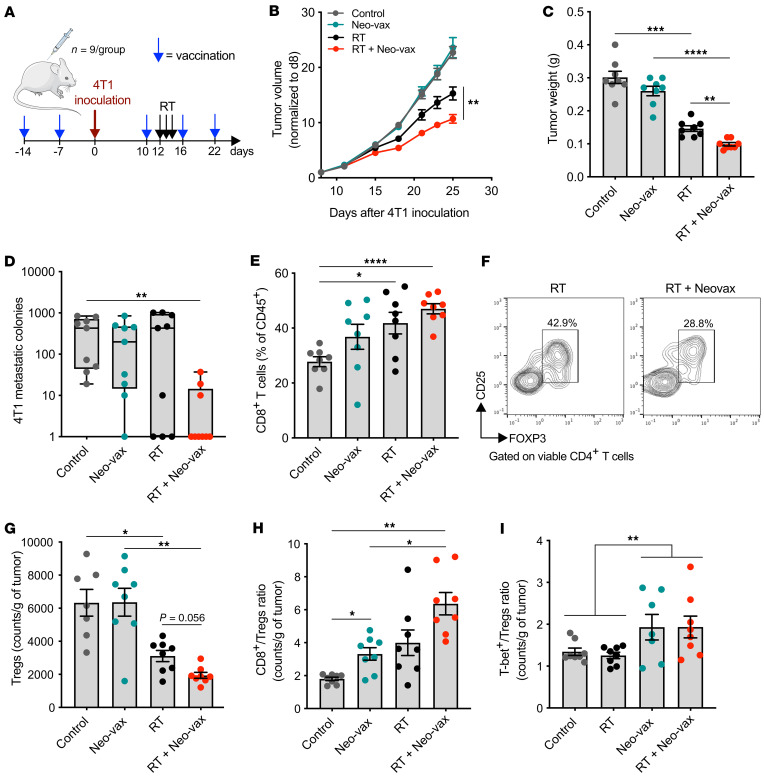
图10 接种辐射上调的新抗原可与放疗联合增强抗肿瘤免疫应答
为了研究确定的新抗原在抗肿瘤免疫应答中的作用,在4T1肿瘤细胞接种之前,小鼠单独接种Neo-vax或佐剂两次,然后每周接种(图10A)。每组半数小鼠接受肿瘤局部放射治疗,连续3天给予8 Gy的剂量。Neo-vax不能保护小鼠免于肿瘤发展,但它显著改善了局部放疗的肿瘤控制(图10,B和C)。与对照组相比,仅在Neo-vax和放射治疗的小鼠中自发肺转移显著减少(图10D)。与未处理的肿瘤相比,CD8+ T细胞明显增多,CD4+ CD25+ FOXP3+调节性T细胞(Treg)明显减少(图10,E-G)。Neo-vax组CD8+ /Treg比值显著升高,Neo-vax与放疗联合使用后进一步改善(图10H)。Neo-vax治疗小鼠肿瘤中T-bet+ /Treg 细胞比值在与放疗无关的情况下增加(图10I)。总的来说,这些结果表明,新抗原疫苗接种改善了放疗小鼠局部和全身的抗肿瘤免疫反应。
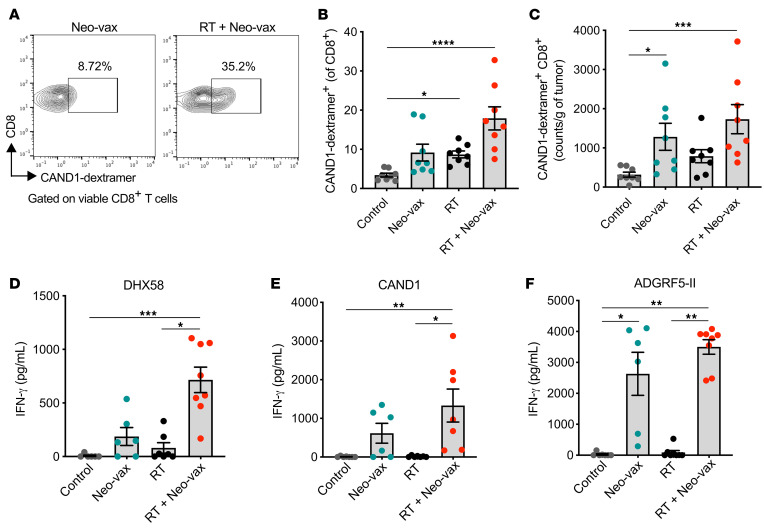
图11 放疗增强T细胞对辐射上调的新抗原的反应
为了进一步表征新抗原特异性T细胞的反应,我们用带有CAND1新表位的H2-Kd葡聚糖对肿瘤浸润T细胞进行染色。与对照组小鼠相比,放疗联合Neo-vax治疗的小鼠肿瘤中,CAND1特异性CD8+ T细胞显著增加(图11,A-C)。在接受Neo-vax或放疗的小鼠肿瘤中,cand1特异性T细胞的频率和数量也有所增加,尽管比两种治疗联合时要低,这表明放疗有助于启动cand1特异性CD8+ T细胞。在肿瘤引流淋巴结中,只有当Neo-vax联合放疗时,才出现CD8+新表位(DHX58和CAND1)体外刺激后产生IFN-γ的情况(图11,D和E),进一步支持作用辐射增强T细胞反应针对radiation-upregulated neoantigens。相比之下,CD4+新表位ADGRF5-II刺激后IFN-γ的产生是由Neo-vax驱动的,与放疗无关(图11F)。
(6)放射上调新抗原的治疗性疫苗接种可提高肿瘤控制和生存率
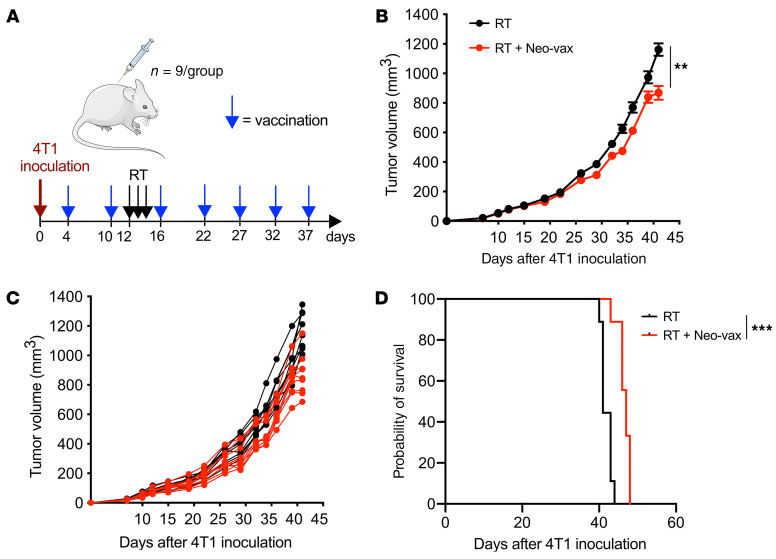
图12 新抗原疫苗联合放疗的治疗效果
以上实验表明,Neo-vax激活的抗肿瘤T细胞能够抑制照射后4T1肿瘤的生长和肺转移。为了检验治疗性疫苗接种是否有效,小鼠在接种肿瘤后免疫,几天后进行肿瘤局部放疗(图12A)。与单纯放疗相比,放疗加Neo-vax治疗的小鼠肿瘤进展显著延迟;与预防性接种相比,效果有所延迟(图12,B和C)。与预防接种的效果进行比较,这表明新抗原特异性T细胞扩增可能发生缓慢,至少需要1次疫苗接种。尽管如此,接种疫苗在生存率方面的改善虽小但意义重大(图12D)。
(7)新抗原特异性CD8+和CD4+ T细胞是新抗原疫苗有效的必要条件
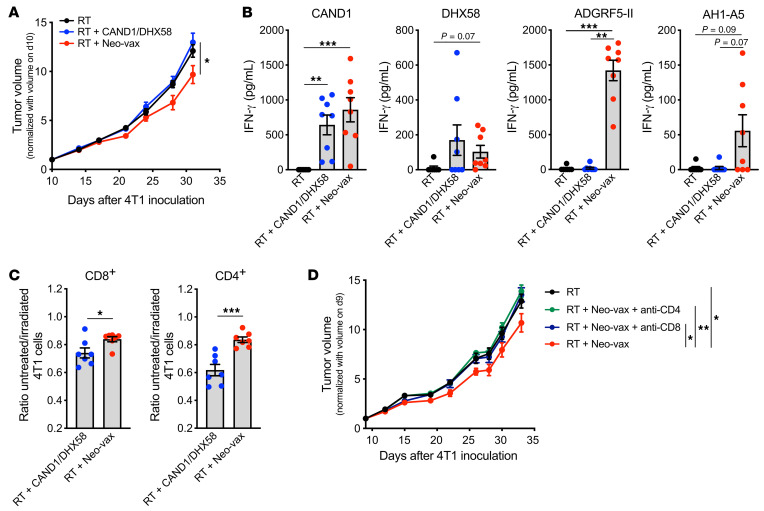
图13 CD4+和CD8+新抗原特异性T细胞是疫苗抗肿瘤活性所必需的
最近的研究表明,抗肿瘤免疫反应的成功取决于肿瘤新抗原的表达,这些新抗原同时激活CD4+和CD8+T细胞。为了检测MHC-II新表位ADGRF5-II对抗肿瘤免疫反应的贡献,小鼠接种了3种多肽,或仅接种了DHX58和CAND1。在缺乏ADGRF5-II的情况下,接种疫苗改善辐照4T1肿瘤控制的能力丧失(图13A)。为了了解这种活性丧失的机制,在第31天采集肿瘤引流淋巴结,并检测在体内新抗原刺激下IFN-γ的产生。在疫苗中包含MHC-II新抗原,不需要启动CAND1和dhx58特异性CD8+ T细胞(图13B)。ADGRF5- II特异性CD4+ T细胞在肽刺激后产生大量IFN-γ。此外,尽管与新抗原特异性T细胞相比,CD8+表位AH1-A5对IFN-γ的诱导程度较低,但表明疫苗需要激活CD4+ T细胞才能促进抗原扩散(图13B)。这一解释与CT26肿瘤模型中CD4+ T细胞新表位接种联合局部肿瘤放疗效果的数据一致。
为了评价新抗原特异性T细胞的细胞毒活性,我们从接种DHX58和CAND1或Neo-vax的4T1小鼠身上收集脾细胞。用CAND1或ADGRF5-II体外再刺激后,分离CD8+和CD4+ T细胞作为效应细胞,以4T1为靶细胞进行体外杀伤实验。当从接受Neo-vax的小鼠中获得CD8+ T细胞时,辐照4T1细胞的相对杀伤显著提高,这表明辅助性CD4+ T细胞的存在改善了肿瘤特异性细胞毒性CD8+ T细胞的系统扩增(图13C)。出乎意料的是,CD4+ T细胞对辐照后的4T1细胞也有显著的杀伤作用(图13C)。此外,CD8+ T细胞或CD4+ T细胞的缺失消除了Neo-vax的作用(图8D),表明这两种T细胞群体都是需要的。
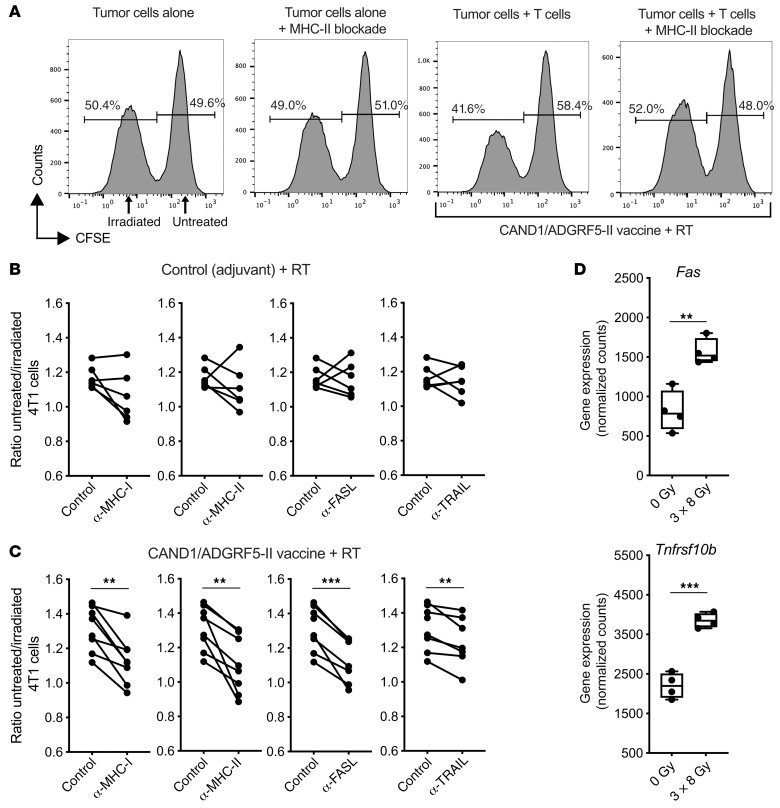
图14 CD4+和CD8+新抗原特异性T细胞以MHC受体和死亡受体依赖的方式杀伤肿瘤细胞
为了证实新抗原特异性CD4+ T细胞对4T1细胞的杀伤能力,我们从接种了佐剂对照或CAND1和ADGRF5-II新抗原的小鼠身上获得肿瘤引流淋巴结细胞,并按照上述方法进行体外杀伤试验。通过阻断MHC-I和MHC-II,辐照4T1细胞的杀伤降低(图14,A-C),表明CD4+和CD8+ T细胞的贡献。CD4+ T细胞的细胞毒性已被证明依赖于靶细胞的Fas表达。一致地,4T1细胞的Fas表达被辐射显著增强(图14D),阻断Fas配体(FASL)减少了新抗原免疫小鼠淋巴结T细胞对辐照后的4T1细胞的杀伤(图14C)。辐射也上调了Tnfrsf10b(编码死亡受体DR5)在4T1细胞中的表达,并且在阻断DR5配体TRAIL后,可以看到辐射4T1细胞杀伤的微小但显著减少(图14,C和D)。
结论:这些研究结果表明,CD8+和CD4+新抗原是新表位疫苗抗肿瘤活性所必需的。在放射治疗的背景下,新抗原特异性CD4+ T细胞可能有助于疫苗的治疗效果,不仅通过CD8+T细胞的效应功能,而且通过直接杀死癌细胞,反映了辐射能够上调癌细胞上MHC-II抗原和死亡受体的表达。因此,放射治疗作为一种理想的组合伙伴,可以提高目前临床正在进行的个体化新抗原接种方法的疗效。
部分相关产品(可直接联系优宁维哦~)
体内抗体
InVivoMab anti-mouse MHC Class I (H-2)
InVivoMab anti-mouse MHC Class II (I-A/I-E)
InVivoMAb anti-mouse FasL (CD178)
核酸提取
RNeasy Plus Mini Kit (50)
样本制备
Spleen Dissociation Kit, mouse
Red Blood Cell Lysis Buffer
MACS SmartStrainers (70 µm)
Tumor Dissociation Kit,Mouse
Lung Dissociation Kit,Mouse
gentleMACS Octo Dissociator
磁珠分选
Pan T Cell Isolation Kit II, Mouse
CD4+ T Cell Isolation Kit, mouse
CD8a+ T Cell Isolation Kit, mouse
MidiMACS Starting Kit (LS)
Mini&MidiMACS Starting Kit (MS, LS)
QuadroMACS Starting Kit (LS)
autoMACS Running Buffer 6 X 1,5L
MACS BSA Stock Solution 6 x 75 ml
autoMACS Rinsing Solution 6 x 1,45 L
流式检测
CD8a Antibody, anti-mouse, PE
Ms CD4 PerCP-Cy5.5 RM4-5 100ug
CD3ε Antibody, anti-mouse, APC
Hu IFN-γ Alexa 700 B27 100ug
Hu TNF PE-Cy7 MAb11 100Tst
Ms IL-10 APC JES5-16E3 25ug
Mouse IFN gamma ELISA Kit
CD19 Antibody, anti-mouse, APC
Ms CD45 HorizonV450 30-F11 50ug
CD16/CD32 Antibody, anti-mouse, pure
FoxP3 Antibody, anti-mouse, PE, REAfinity
细胞冻存
CryoMACS DMSO 10 (EP)
上海优宁维生物科技股份有限公司
试剂 | 耗材 | 仪器 | 软件 | 定制 | 实验服务 | 供应链
免费热线:4008-168-068
咨询邮箱:info@univ-bio.com
订购商城:www.univ-bio.com
微信公众平台:优宁维抗体专家,欢迎关注!
小优博士(小程序):5大课堂, 让你的科研不再难!

