背景及概述[1][2]
过碳酸钠是由碳酸钠和过氧化氢复合形成的一种新型氧系漂白剂。外观为白色,松散、流动性较好的颗粒状或粉末状固体。它易溶于水,10 ℃时溶解度为12 .3 g/100g H2O,并随着温度升高,其溶解度也相应增大。过碳酸钠是一种无毒的物质,但其固体粉末状物或浓度较高的溶液对皮肤、粘膜和眼睛均有一定的刺激性,但在稀释溶液中无任何刺激作用,所以在实际使用中不会对环境产生污染;它也属热敏性物质,干燥的过碳酸钠在120 ℃分解,但在遇水遇热以及重金属和有机物质混合时,极易分解生成碳酸钠、水和氧气,其稳定性随温度的上升而下降。
过碳酸钠在水中易离解成碳酸钠和过氧化氢,在碱性溶液中因过氧化氢进行反应生成水和氧,生成的氧具有漂白作用,从而显示极强的漂白性,而且它具有碳酸钠和过氧化氢的双重性质,水溶液呈碱性,3 %水溶液的pH 值为10~11。过碳酸钠与酸中和生成相应的钠盐,并放出二氧化碳,可用以定量地测定过碳酸钠。过碳酸钠与传统的硼系、磷系洗涤助剂类似,遇水释放出氧原子而呈现出漂白和杀菌作用,而且它无毒、无害,又能保持织物原有色彩和光泽,非常适用于合成纤维的洗涤、食品餐具的消毒、水果的保鲜,还可用作污水处理剂、氧气发生剂等。
性质[1]
过碳酸钠的理论活性氧值为15.28 %,其分子结构包括3 种类型:Na2CO3·2H2O2、Na2CO3·nH2O2·mH2O 和2Na2C2O3·3H2O2 。由于制法不同,性质也有所差异。目前市场上销售的产品均属于Na2CO3·nH2O2·mH2O类型,外观为白色、松散、流动性较好的颗粒状或粉末状固体,易溶于水,10 ℃时溶解度为12.3g/100g H2O,并且随着温度的升高,其溶解度也相应增加过碳酸钠属热敏性物质,干燥的过碳酸钠在120 ℃分解,但在遇水、遇热以及与重金属和有机物质混合时,极易分解生成碳酸钠、水和氧气,其稳定性随温度的上升而下降。
所以在生产过程中需要加入稳定剂,以得到稳定性好的过碳酸钠产品,保证其在一定贮存期内仍具有高活性的氧含量,并且在低温和干燥的条件下存放。过碳酸钠在水中易离解成碳酸钠和过氧化氢,在碱性溶液中因过氧化氢生成水和氧,生成的氧具有漂白作用,从而显示出极强的漂白作用。
过碳酸钠是一种无毒的物质,其固体粉状物或浓度较高的溶液对皮肤、粘膜和眼均有一定的刺激性,但在稀释溶液中无任何刺激作用,所以在实际使用中不会对环境产生污染。过碳酸钠具有碳酸钠和过氧化氢的双重性质,水溶液呈碱性,3 %水溶液的pH 值为10 —11 。在中性或酸性条件下,过碳酸钠遇到氯、高锰酸钾等强氧化剂表现出一定的还原性,可作为测定过碳酸钠含量的依据。过碳酸钠与酸中和生成相应的钠盐,并放出二氧化碳,可用以定量地测定过碳酸钠。
应用[1]
1. 洗涤助剂
传统的氧系漂白剂主要为过硼酸钠,虽然过硼酸钠也有较高的活性氧,长期广泛用作漂白剂的组分,但其水中的溶解速度在低于20 ℃时比较缓慢,所以在冷水中的漂白效果不理想。另外还存在价格较高以及硼元素对农作物有影响等缺点。而过碳酸钠无味、无毒,在冷水中也易于溶解,溶于水后能释放出氧而起到漂白杀菌等多种功效,符合现代洗涤剂发展潮流。
加上其生产成本比过硼酸钠低,适宜寒冷地区和冬天使用,又不会对农作物产生危害,因此在洗涤剂中正逐渐取代过硼酸钠而得到日益广泛的应用。将过碳酸钠作为一种活性组分添加在洗涤剂中,可以提高其去污能力,又不会带来二次污染。与传统的氯系漂白剂相比较,过碳酸钠无臭、无毒、无污染、它释放的活性氧具有优良的去渍增白功能,碳酸钠本身也有较好的去污能力,所以被视为理想的洗涤剂组分。
过碳酸钠没有较浓的异味,对有芳香味的有机添加剂及增白剂无破坏作用,且能保持其香味,特别适合用作低磷或无磷洗涤剂,克服磷对水质的污染,因而特别适用于氯系漂白剂所不适用的合成纤维、动物纤维、树脂加工纤维和荧光增白剂处理过的纤维等,且不易使布料损坏。此外,过碳酸钠在造纸工业中也可用作纸浆漂白剂,以减少对环境的污染。
2. 急救氧气源
由于过碳酸钠易分解放出氧气,如果在合适的催化剂(如锰、铁、铜等化合物)存在下控制氧气产生的速率,就可将过碳酸钠作为急救用的氧源使用。用不同浓度的聚乙烯醇(或乙二醇、阿拉伯胶等)分别将催化剂(锰、铜、铁、钴化合物)制成在水中溶速度不同的固体物,一起混入过碳酸钠中。当需要氧气时,在固体物中加入适量的水,由于它们的溶解速度不同,所以能依次与过碳酸钠接触并发生反应,逐次放出氧气。
这样只要调配好固体催化剂在水的溶解度,就可保证过碳酸钠均匀、持续地放出氧气,以满足急救的需求。与氧气瓶或其它药剂供氧相比,利用过碳酸钠发生氧用于急救供氧,处理简便,使用安全,价格便宜,特别适合于如护送病人医院途中的呼吸用氧、前线伤员、边远地区病人的临时急救用氧、解决火灾发生地区和地下设施的暂时缺氧等场合使用。
3. 化学合成
近年来,过碳酸钠在化学方面的应用越来越广泛。如过碳酸钠可用于醛基转化为酚羟基化反应、有机硼烷氧化、腈水解等反应中。此外,还可用于硫醚与胺的氧化、烯烃的环氧化、酮的氧化以及α-二酮的断裂氧化等反应中。
4. 食品、餐具的消毒
由于过碳酸钠是一种新型氧系漂白剂,具有灭菌消毒作用,因而大量用于食品和餐具的洗涤和消毒方面。如1 %的过碳酸钠溶液在26 ℃以上可杀灭大肠杆菌以及葡萄球菌等;2.5 %的过碳酸钠溶液在38 ℃时可杀灭肝炎病毒。另外,过碳酸钠还可用于食品保鲜消毒,1 %的过碳酸钠水溶液可使水果和蔬菜在贮存4 —5 个月后仍保持不腐烂变质。
5. 其它
过碳酸钠可以替代过氧化钙作为水产养殖业的产氧剂,放氧速度明显高于过氧化钙,并可给在贮运过程中的鱼、虾、蟹等生物供氧保鲜。另外,过碳酸钠还可用作还原染料和硫化染料的显色剂、口腔消毒剂、金属表面处理剂、电镀洗涤剂、污水处理剂以及高分子聚合控制剂等。
稳定性[3]
提高过碳酸钠稳定性是产品生产的关键,影响过碳酸钠稳定性的因素主要有环境的湿度、温度以及产品中金属杂质的含量,所以增加过碳酸钠稳定性的途径大致有减少原料的杂质含量,尤其是重金属离子;添加无机物和有机物使其与金属离子形成螯合物;用某些有机和无机化合物包复过碳酸钠粒子,以隔绝与湿空气接触的机会,改善产品的贮存环境。
1. 减少原料中的杂质
工业用碳酸钠中一般含有铁、锰、铜等金属离子,这些金属离子能促进过碳酸钠的分解,致使过碳酸钠稳定性降低.要除去这些金属离子可以将碳酸钠溶解在水中,加硫酸镁和硅酸钠沉淀出杂质,把得到的精制碳酸钠水溶液供给反应系统,或在连续的有精制工序的过碳酸钠制造工序中,在过滤碳酸钠后的滤液中加入所需要量的碳酸钠和水,用同样的方法也可以除去重金属。该法虽能较容易地除去促使过氧化氢分解的金属,但在反应物系中有过量水存在,故溶解在该过量水中的过碳酸钠损失大,从工业角度看,不能算是一种好的方法。
2. 加入适当的稳定剂
经多方面研究认为,在碳酸钠与过氧化氢反应过程中加入有机螯合物和各种无机盐类,可以大大提高制得的过碳酸钠的稳定性。加入的稳定剂的种类很多,可分为无机化合物和有机化合物两大类。
1)无机化合物有:(1)磷酸或磷酸盐类:如正磷酸;磷酸;磷酸钠;磷酸二氢钠;六偏磷酸钠;焦磷酸钠等。(2)碱金属或碱土金属盐类:如硫酸钠;硫酸镁;氯化镁等。(3)硅酸盐类:如硅酸钠;偏硅酸钠等.(4)硼酸或硼酸盐:如硼酸;偏硼酸钠等。
2)有机化合物有:(1)有机胺类化合物:如乙撑二胺四醋酸盐;二乙烯三胺五醋酸盐等。(2)醇类化合物:如聚乙二醇类、聚乙二硫醇类化合物.(3)螯和物与表面活性剂:如8 -羟基喹啉;α-苯偶姻肟等。(4)脂肪族氨基酸及其盐类:如乙氨酸;谷蛋白;明胶等。(5)芳香族化合物:如磺酸镁盐;高级脂肪醇的硫酸脂镁盐等。(6)铵盐羧酸盐类:如EDTA。(7)非离子表面活性剂:如高级醇;高级脂肪的甘油脂等.稳定剂的选择多采用一种或两种以上无机和有机化合物组合,这样比采用单一稳定剂的稳定效果更佳,就一般原料和操作条件而言,无机化合物添加量一般在0 .01 %~ 1 %,有机化合物添加量在0 .02 %~ 0 .5 %。用上述稳定剂可使制得的过碳酸钠的有效氧含量高,结晶中的过氧化氢和碳酸钠的组成液接近理论值,产品质量好,储存稳定性能好。
3. 用有机物、无机物覆盖过碳酸钠
成膜的处理方法是将碱土金属盐类水溶液喷到过碳酸钠上进行混合搅拌或将碱土金属盐类水溶液加入到过碳酸钠水的悬浮液中混合搅拌,处理后的过碳酸钠用过滤或离心分离的方法进行分离,然后进行水洗、干燥得到稳定的过碳酸钠.另外,改进过碳酸钠的合成工艺及稳定剂的配方,也是一种有效地提高过碳酸钠稳定性的途。
制备[3]
1. 原理
过碳酸钠合成方法中,虽然不同的方法可以制取不同组成形式的过碳酸钠,但最基本的原理都是由碳酸钠、过氧化氢和水三组分体系,它们利用氢键所形成的不太稳定加成化合物过碳酸钠,反应方程式如下:
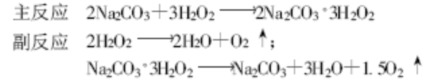
2. 过碳酸钠的合成方法
过碳酸钠性质的特殊性质决定着其制备方法的特殊性,当代对过碳酸钠的研究主要集中在其制备方法的研究方面,过碳酸钠的主要制备方法有干法和湿法两大类。所谓干法就是在流动气流中将碳酸钠水溶液和过氧化氢水溶液喷雾在过碳酸钠晶种上,干燥并使结晶成长,或者直接将过氧化氢添加到Na2CO3颗粒上并进行反应;湿法则是由过氧化氢和碳酸钠水溶液以一定的温度在间歇式或连续式结晶反应器中进行反应、结晶、再经干燥而得成品,经分离得到的母液可返回反应工序重新利用.湿法是目前普遍采用的生产工艺。主要包括喷雾法、结晶法和醇析法。
1)常温合成过碳酸钠
先在反应器中加入一定量的无水碳酸钠和一定体积的蒸馏水,溶解后加入稳定剂,使温度保持在15~20 ℃之间,按无水碳酸钠与过氧化氢的摩尔比为1∶1 .5,滴加到碳酸钠溶液中,反应60 分钟后,减压过滤,产品50~55 ℃烘干,即得产品.母液经蒸馏,可以循环使用。
2)粒状过碳酸钠的制备
在搅拌下,在氯化钠和碳酸钠的溶液中,加工业碳酸钠制成悬浊液,另将含有稳定剂的过氧化氢按一定比例和一定速度加入,整个过程控制在15 ~30 ℃范围,保持1~2 小时。固液分离,干燥,得小颗粒状产品。
3)改良湿法制备过碳酸钠
改良湿法是新近开发的制备稳定过碳酸钠的新工艺,它是在低浓度的双氧水中,加入一定的碳酸钠,反应后,过滤,干燥,即可得到稳定的过碳酸钠。该法工艺简单,流程短,产品收率高,工艺条件容易掌握。
4)高稳定过碳酸钠的制备
将一定比例的工业碳酸钠、50 %双氧水、稳定剂和盐析剂加入母液中,然后再向体系中逐渐加入工业碳酸钠、50 %双氧水、稳定剂和盐析剂,待反应完全后,晶体过滤,干燥即得产品。
5)稳定性过碳酸钠的合成
用含有一定量双氧水和碳酸钠得溶液作为母液,然后在将含有稳定剂的双氧水和碳酸钠分次加入到体系中,加料完成后,继续反应2 小时,静置结晶,过滤,干燥即得产品。
6)其它制备过碳酸钠的方法
当过氧化氢与碳酸钠反应时,加入适量的硅酸盐(偏硅酸钠或硅酸钠)和镁盐(硫酸镁或氯化镁)一起反应。分离出来的块状过碳酸钠可选用下述两种方法处理:①按每75~92 质量分数的过碳酸钠加入2 .5~8 质量分数的浓度为1.5 %-10 %的双氧水的比例处理,所得混合物用压片法等造粒,即可得到吸湿性小的过碳酸钠;②按每100 质量分数的过碳酸钠加入0 .05~15 质量分数的镁盐或二胺四乙酸盐的比例处理,所得混合物用压片法等造粒,也可得到溶解性好的过碳酸钠。
用沸腾床技术合成过碳酸钠,其合成工艺是,在沸腾床反应器内将碳酸钠和过氧化氢溶液混合,鼓入空气使二者反应生成过碳酸钠微晶。微晶在此处不断扩大,直到合乎要求。排出晶粒进行涂层工序,涂层室也采用沸腾技术。用可相容的无机盐类形成均匀的涂层以稳定过碳酸钠的活性氧,该法制得的过碳酸钠活性氧含量约为13 %。
在有氯化钠或硫酸钠、镁离子、六偏磷酸盐存在的情况下,通过碳酸钠与过氧化氢反应制备过碳酸钠.在反应器中装入干燥的过碳酸钠粒子,再在常温下把含质量分数为20 %~ 70 %的过氧化氢溶液与含15 %~ 34 %的碳酸钠溶液加入到反应器中,使过碳酸钠粒子表面润湿,形成附加的过碳酸钠,把经过润湿的过碳酸钠在沸腾床型干燥器中进行干燥,得到的过碳酸钠粒子经过相对湿度小于80 %的沸腾床用气体使其固化,然后选出所需大小的粒子作为产品。
要参考资料
[1] 崔小明. 过碳酸钠的生产和应用[J]. 四川化工, 2004, 7(2): 30-33.
[2] 王香爱, 陈养民. 过碳酸钠的合成与应用[J]. 純鹼工業, 2006, 2006(4): 7-9.
[3] 郑虹ZH. 现代无机助剂过碳酸钠性质及应用[J]. 云南民族大学学报 (自然科学版), 2002, 11(2): 103-106.
