概述【2】
琥珀酸曲格列汀(trelagliptinsuccinate,1)化学名为2-{6-[(3R)-氨基-哌啶-1-基]-3-甲基-2,4-二氧代-3,4-二氢-2H-嘧啶-1-基甲基}-4-氟苄腈琥珀酸盐,是由日本Takeda(武田制药株式会社)开发的二肽基肽酶Ⅳ(DPP-Ⅳ)抑制剂,能够选择性、持续性抑制DPP-Ⅳ,控制血糖水平。临床试验表明,该药有着很好的安全性和有效性,每周给药1次便可有效控制血糖水平,改善患者的用药依从性。2015年5月,该药获日本PMDA批准上市,用于糖尿病的治疗。
药理作用
Trelagliptin(曲格列汀)是一种每周一次的二肽基肽酶IV(DPP-4)抑制剂,通过选择性、持续性抑制DPP-4,控制血糖水平。DPP-4是一种酶,能够引发肠促胰岛素(胰高血糖素样肽-1(GLP-1)和葡萄糖依赖性促胰岛素多肽(GIP))的失活,而这2种肠降胰岛素在血糖调节中发挥着重要作用。抑制DPP-4,能够增加血糖水平依赖性胰岛素分泌,从而控制血糖水平。
药效学【1】
用取自Caco-2细胞的DPP-4为材料,测得曲格列汀的IC50为5.4nmol/L;又以人、狗、鼠的血浆DPP-4为材料,测得曲格列汀的IC50分别为4.2nmol/L,6.2nmol/L和9.7nmol/L。曲格列汀对人类DPP-4重组蛋白的抑制能力优于阿格列汀和西格列汀,其IC50值分别为1.3nmol/L,5.3nmol/L和16.0nmol/L。在酶的特异性实验中,曲格列汀对DPP-2、DPP-8、DPP-9、脯氨酰内肽酶和成纤维细胞活化蛋白α的抑制能力均极低,特异性大于10000倍。进一步研究还发现,曲格列汀对DPP-4为竞争性抑制,且具有慢结合模式的特点。
药物代谢【1】
曲格列汀有两条代谢途径,一条通过CYP2D6脱掉尿嘧啶3位的甲基,得到活性代谢产物M-1(图1),另一条通过CYP3A4转化为其它非活性代谢产物。活性代谢产物M-1在血浆中的达峰浓度(Cmax)不超过未代谢曲格列汀的1%。曲格列汀对各种CYP酶(包括CYP1A2、CYP2B6、CYP2C8、CYP2C9、CYP2C19和CYP2D6)均无明显抑制作用。
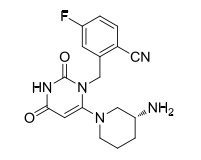
图1为活性代谢产物M-1
制备方法【3】【4】
1.以6-氯-3-甲基尿嘧啶为起始原料,通过 2 次亲核取代、氯化氢-甲醇溶液脱 Boc,再与琥珀酸成盐制得琥珀酸曲格列汀。
(1)2-[(6-氯-3,4-二氢-3-甲基-2,4-二氧代-1(2H)-嘧啶基)甲基]-4-氟苯腈(4)的合成
向装有球形冷凝管、温度计和机械搅拌的3L三颈瓶中,依次加入192.7g(1.20mol)6-氯-3-甲基尿嘧啶(2)、331.7g(2.40mol)碳酸钾、2.1LN,N-二甲基甲酰胺(DMF)和299.7g(1.40mol)5-氟-2-氰基溴苄(3),搅拌下,将反应混合物缓慢升至80℃,反应5h。抽滤,滤液减压浓缩回收DMF至干。稍冷却后向其中加入二氯甲烷和等体积的水,搅拌分散,静置。分取有机层,水层以二氯甲烷萃取,合并有机层,用饱和氯化钠溶液洗涤,干燥。过滤,减压浓缩滤液至有大量固体析出,冷却至室温并搅拌3h。抽滤,减压干燥,得到类白色固体(4)266.0g,收率75.5%。
(2)2-[[6-[(3R)-3-(叔丁氧羰基)氨基哌啶-1-基]-3-甲基-2,4-二氧代-3,4-二氢嘧啶-1(2H)-基]甲基]-4-氟苯腈(8)的合成
向装有球形冷凝管、温度计和机械搅拌的3L三颈瓶中,依次加入234.9g(0.80mol)化合物4、221.1g(1.60mol)碳酸钾、1.6LN,N-二甲基甲酰胺(DMF)和180.3g(0.90mol)(R)-3-Boc-氨基哌啶(7),搅拌下,将反应混合物缓慢升至80℃,反应6h。抽滤,减压浓缩滤液回收DMF至干。稍冷却后向其中加入二氯甲烷和等体积的水,搅拌分散,静置。分取有机层,水层以二氯甲烷萃取,合并有机层,饱和氯化钠溶液洗涤,干燥。过滤,减压浓缩滤液至有大量固体析出,冷却至室温并搅拌3h。抽滤,减压干燥,得到类白色固体(8)301.8g,收率82.5%。
(3)曲格列汀盐酸盐的合成
在冰水浴下,将1.8L氯化氢甲醇溶液(2.50mol?L-1)缓慢滴加至137.3g(0.30mol)化合物8与800mL甲醇的混合液中,加毕,继续搅拌反应10h。抽滤,减压干燥,得到白色固体(曲格列汀盐酸盐)102.2g,收率86.5%,纯度97.8%。
(4)琥珀酸曲格列汀(1)的合成
搅拌下,将78.8g(0.20mol)曲格列汀盐酸盐加入到800mL冷水和500mL二氯甲烷的混合溶液中,缓慢向其中滴加质量分数为20%的氢氧化钠溶液,调pH值至10,静置,分取有机层,水层以二氯甲烷萃取,合并有机层,饱和氯化钠溶液洗涤,干燥,抽滤,减压浓缩滤液至干,得到白色游离的曲格列汀。在加热、搅拌条件下,将游离的曲格列汀溶于600mL甲醇中,升温至60℃左右,向其中滴加由24.8g琥珀酸与100mL甲醇组成的溶液,加毕,继续保温搅拌1h。自然降至室温,继续搅拌4h使固体充分析出。抽滤,减压干燥,得到白色固体(1)76.1g,收率80.0%。
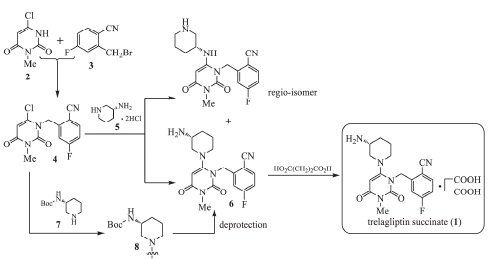
图2为琥珀酸曲格列汀的合成路线1
2.以2-溴-5-氟甲苯(2)为原料,经偶联上氰基、自由基反应、取代等制得曲格列汀三氟乙酸盐,碱解后成盐得到曲格列汀琥珀酸盐。
(1)4-氟-2-甲基苄腈(3)的合成
将Na2CO32.8g(26mmol)和Pd(OAc)20.01g(0.07mmol)加入到10mLN-甲基吡咯烷酮(NMP)中搅拌,滴加异丙醇和水(5∶3)的混合溶液4mL,室温条件下搅拌10min,一次性加入2-溴-5-甲苯5g(26mmol)的NMP溶液,同时升温至130℃,加入亚铁氰化钾2g(5.4mmol),N2保护,反应14h,冷却至室温,加入40mL水稀释反应液,用正己烷(30mL×3)萃取,合并有机相,用饱和食盐水(30mL×3)洗涤,无水硫酸钠干燥,减压抽真空得粗产品(3)3.2g,重结晶得白色结晶2.21g(65%),mp:70~74℃。
(2)2-溴甲基-4-氟苯腈(4)的合成
将2.21g(16.3mmol)化合物3,NBS1.6g(8.95mmol)、AIBN(0.05equiv)、15mL环己烷加入三颈烧瓶中,N2保护,无水无氧环境,升温到60℃,保温反应1h,补加NBS1.6g、AIBN(0.5equiv),TLC跟踪反应至结束。冷却反应,真空抽滤得橘黄色有刺激性液体,减压旋干溶剂得棕色油状粗产品(4)3.1g,在没有进一步纯化下将其用于下一步中。
(3)2-(6-氯-3-甲基-2,4-二氧代-3,4-二氢-2H-嘧啶-1-基甲基)-4-氟-苄腈(5)的合成
将3g(18.7mmol)3-甲基-6-氯尿嘧啶溶解在20mL二甲基亚砜(DMSO)中,于30℃搅拌至反应液澄清,缓慢滴加3.6g三乙胺溶液,滴加完毕后反应30min待用,用10mLDMSO和2mLDMF的混合溶液溶解2-溴甲基-4-氟苯腈(4),缓慢滴入上述待用反应液中,室温过夜。反应结束后加20mL水稀释,用乙酸乙酯(30mL×3)萃取,合并有机相,加入1g活性炭褪色,过滤、减压旋干溶剂,向其中倒入30mL冰水,立即有大量沉淀生成,静置、抽滤、洗涤滤饼、烘干产品得粗产品(5)4g,用THF和正己烷的混合溶液重结晶,得白色粉末2.86g(70%)。
(4)2-[6-(3-氨基-哌啶-1-基)-3-甲基-2,4-二氧代-3,4-二氢-2H-嘧啶-1-基甲基]-4-氟-苯腈TFA盐(6)的合成
将2.86g(9.7mmol)化合物5,R-3-哌啶双盐酸盐,NaHCO3(5g)溶解在20mL无水乙醇中,搅拌升温至100℃,TLC监测反应完全,冷却至室温,过滤,用无水乙醇洗涤滤饼,减压旋干溶剂,用二氯甲烷(DCM)溶解产物,饱和食盐水洗涤,萃取水相,合并有机相,与TFA成盐,有产品析出,过滤,洗涤滤饼,得白色结晶(6)3.8g,纯化产品得2.97g(65%)。
(5)曲格列汀琥珀酸盐(1)的合成
将化合物6(2.97g),二氯甲烷20mL,和纯化水10mL混合,向混合溶液滴加饱和的碳酸钾溶液,调节pH值,直到混合物的pH>12,分液、萃取水相、合并有机相、用水洗涤、干燥、减压旋干得灰白色固体形式的游离碱。将游离碱溶解在10mLTHF和5mLIPA的混合溶液中,加热至60℃,直至溶液澄清,滴加琥珀酸的THF溶液,有结晶缓慢析出,保温反1h,冷却至25℃搅拌过夜,抽滤,洗涤滤饼,真空干燥,得到白色的曲格列汀琥珀酸盐(1)2.4g,收率80%。
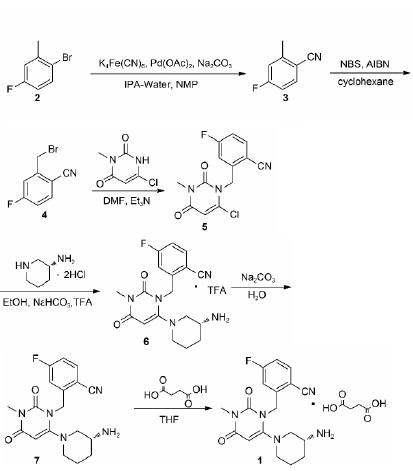
图3为琥珀酸曲格列汀的合成路线2
适应症
用于Ⅱ型糖尿病的治疗。
主要参考资料
[1]徐声辉. 琥珀酸曲格列汀合成工艺及有关物质研究[D].上海医药工业研究院,2017.
[2]褚青松,黄坤,李威,秦雄剑.琥珀酸曲格列汀有关物质的合成[J].中国药物化学杂志,2016,26(04):326-329.
[3]何文鹏,许文青,白旭,辛海龙,贾娴,许佑君.琥珀酸曲格列汀的合成及初步HPLC质量控制研究[J].中国药物化学杂志,2017,27(01):29-34.
[4]江洁滢,游莉,邓思思,邓俊丰,刘瑜,张晓.琥珀酸曲格列汀的合成[J].中国新药杂志,2015,24(16):1876-1878+1910.
