简介
3-乙氧基-4-甲氧基苯腈是一种重要的医药、农药、液晶材料、聚合物材料、光记录材料等的中间体,特别是拟除虫菊酯类杀虫剂四氟苯菊酯、七氟菊酯、丙氟菊酯、四氟甲醚菊酯、甲氧苄氟菊酯等的重要中间体[1-3]。3-乙氧基-4-甲氧基苯腈的结构式如图1所示。
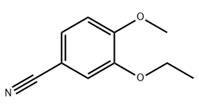
图1 3-乙氧基-4-甲氧基苯腈的结构式。
合成
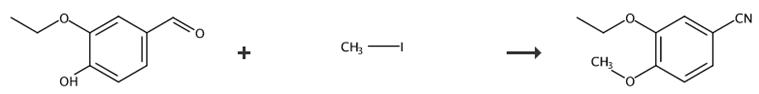
图2 3-乙氧基-4-甲氧基苯腈的合成路线[4]。
步骤1:合成表1分子No. 88:在NaOH水溶液(1 M - 5 N水溶液)中,向乙基香兰素(1当量-120 mmol)和碘烷(1.5当量)的悬浊液中加入相转移催化剂Aliquat 336(0.1当量)。通过GC-MS分析,混合物回流1小时,达到完全转化。在持续搅拌的情况下,将混合物冷却到0°C,形成白色沉淀物。沉淀的过滤和再结晶从I-Pr2O得到了中间体。3-乙氧基-4-甲氧基苯甲醛,白色晶体,产率(74%)。
步骤2:将醛(1当量:22 mmol)和盐酸羟胺(1.4当量)在乙腈(1 M)中回流2小时,通过GC-MS分析观察到完全转化。加水(40 mL)淬火反应,用Et2O萃取。有机相在减压下富集后,由I-Pr2O再结晶。这就得到了3-乙氧基-4-甲氧基苯腈,收率(54%)。合成路线如图2所示。
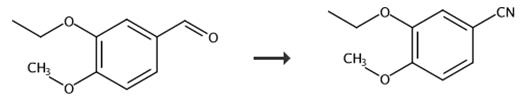
图3 3-乙氧基-4-甲氧基苯腈的合成路线[5-6]。
方法一:3-乙氧基-4-甲氧基苯甲醛(10.0 g, 54.9 mmol, Aldrich)和盐酸羟胺(4.67 gm, 65.9 mmol, Aldrich)在室温下装到250 mL三颈烧瓶中,然后加入无水乙腈(50 mL)。反应混合物在室温下搅拌30分钟,然后加热回流(85°C油浴)。回流两小时后,将反应混合物冷却至室温,加入去离子水50 mL。混合物在减压下浓缩以除去乙腈,然后转移到一个分离漏斗中,再加入80毫升去离子水和80毫升二氯甲烷。用二氯甲烷(3 x 50 mL)提取水层。用水(80 mL)和饱和氯化钠(80 mL)依次洗涤组合有机层。有机层在无水硫酸钠(约20克)上干燥。有机层经过过滤和减压浓缩,得到黄色的油。硅胶色谱法(0 ~ 1% MeOH/DCM)纯化得到3-乙氧基-4-甲氧基苯甲腈(化合物2)。最终得到白色固体3-乙氧基-4-甲氧基苯腈,收率(7.69 gm, 79%)。MS (ESI正离子)m/z 178.1 (m + 1), HPLC峰面积为99%纯度。1 H-NMR (500 MHz, DMSO-d6):δ1.32 ppm (t, 3 h), 3.83(3 H), 4.05 (q, 2 H), 7.10 (d J = 8.0H z,1 H), 7.35 (d J = 2.0 Hz,1 H), 7.40 (dd, J = 2.0 Hz,1 H)。合成路线如图3所示。
方法二:3-乙氧基-4-甲氧基苯甲醛(1000克,5.54摩尔,来自奥尔德里奇化学公司,密尔沃基,威斯康星州)和羟胺。将盐酸(462.5 g, 6.6摩尔,来自威斯康星州密尔沃基的奥尔德里奇化学品公司)在室温下装入12升的三颈烧瓶中,然后加入乙腈(5升,来自宾夕法尼亚州匹兹堡的费雪科学公司)。将反应混合物在室温下搅拌15-20分钟,观察到一个潜在的吸热体(低于室温~5-15℃)。吸热物消退后,将反应混合物加热至65-72°C。反应混合物进一步加热至78-84°C回流。回流2-3小时后,将反应混合物冷却至室温,加入去离子水1 L。从反应混合物中取3.5-4.0 L乙腈在真空下蒸馏。用4 L去离子水稀释浓缩残渣,室温搅拌1-2小时。然后在室温下真空过滤混合物。用3-4 L去离子水清洗过滤后的固体。固体在30-32°C、100-125 mm Hg的压力下干燥24-36小时。得到白色固体3-乙氧基-4-甲氧基苯腈收率为940 g (95.5%) (HPLC测定纯度为99.2%)。合成路线如图3所示。
应用
3-乙氧基-4-甲氧基苯腈本身也是一种十分有效的防霉抑菌剂[7]。3-乙氧基-4-甲氧基苯腈与氢氧化钠、醇、酚、硫氢化钠、硫醇、硫酚等发生取代反应,所得产物很多具有广谱抗菌活性[8]。如2,4,5-三氟-6-3-乙氧基-4-甲氧基苯腈可用作农业和园艺杀菌剂及工业防霉剂,对紫外照射特别稳定。因此,3-乙氧基-4-甲氧基苯腈具有十分广阔的发展前景。
参考文献
[1] S. Auvin, O. Lavergne, Q. Chao, Y. Chen, Biphenyl analogues as aromatase and sulfatase dual inhibitors and their preparation and use for the treatment of diseases, Beaufour Ipsen Tianjin Pharmaceutical Co., Ltd., Peop. Rep. China . 2015, p. 75pp.
[2] L. Franch, S. Ghosh, G. Glick, J. Katz, A.W. Opipari, Jr., W.R. Roush, H.M. Seidel, D.-M. Shen, S. Venkatraman, D.G. Winkler, Heteroaryl compounds as NLRP modulators and their preparation, Novartis Inflammasome Research, Inc., USA . 2020, p. 479pp.
[3] B. Fu, A. Zou, L. Luo, Apremilast intermediate and preparation method thereof, Peking University Founder Group Co., Ltd., Peop. Rep. China; Chongqing Southwest Synthetic Pharmaceutical Corp., Ltd.; PKU HealthCare Industry Group Co., Ltd. . 2017, p. 9pp.
[4] S.Y. Ho, A. Poulsen, S.W.E. Tan, S.H. Ang, T.H. Keller, Preparation of ((aryloxy)ethoxy)azoles as isoprenylcysteine carboxyl methyltransferase inhibitor, Agency for Science, Technology and Research, Singapore . 2019, p. 173pp.
[5] F. Jean-baptiste-dit-Dominique, S. Ivanov, R. Nasybullin, O. Ugolnikov, Nitrogenous dipole compounds comprising cyclic carbonate functions, Compagnie Generale des Etablissements Michelin, Fr. . 2020, p. 48pp.; Chemical Indexing Equivalent to 173:199848 (FR).
[6] H. Nara, M. Daini, A. Kaieda, T. Kamei, T. Imaeda, F. Kikuchi, Preparation of fused dihydropyridinone derivatives as janus kinase (JAK) inhibitors, Takeda Pharmaceutical Company Limited, Japan . 2013, p. 500pp.
[7] N. Srinuvasu, M. Boruah, B. Balram, B. Ram, B. Taara, Synthesis and antibacterial activity of 2-{2-[(4-chlorophenyl)sulfanyl]ethoxy}-3-methoxy-5-[6-(3,4,5-trimethoxyphenyl)-3-pyridazinyl]benzonitrile, Pharma Chem. 4(5) (2012) 2124-2129.
[8] P.V. Swamy, K.B. Chandrasekhar, P.C. Kambhampati, Synthesis and antibacterial activity of 2-2-[(4-chlorophenyl) sulfanyl] ethoxy-3-methoxy-5-[5-(3,4,5-trimethoxyphenyl)-2-furyl]benzonitrile, Pharma Chem. 7(3) (2015) 242-247.
