背景[1-6]
AGL1(pSoup)感受态细胞为C58,RecA型背景,核基因中含有筛选标签——利福平抗性基因rif和羧苄青霉素抗性基因carb,为了便于转化操作,此菌株携带一无自身转运功能的琥珀碱型Ti质粒pTiBo542DT-DNA,此质粒含有vir基因(vir基因是T-DNA插入植物基因组必需的元件,pTiBo542DT-DNA质粒自身的T-DNA转移功能被破坏,但可以帮助转入的双元载体T-DNA顺利转移)。AGL1菌株适用于水稻、拟南芥、杨树等植物的转基因操作。唯地生物开发的AGL1电转感受态特别适用于大质粒的转化:经pCAMBIA2301质粒(size:11633bp)检测转化效率>105 cfu/μg DNA;经pCAMBIA2301-ZH质粒(size:40kd)检测转化效率可达5×103 cfu/μg DNA。
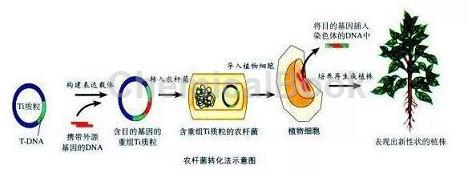
操作方法:
1.0.1 cm电击杯和杯盖从储存液中拿出倒置于干净的吸水纸上5分钟,待其沥干水分,正置5分钟,使乙醇充分挥发,待乙醇挥发干净立即插入冰中,压实冰面,电极杯顶离冰面0.5 cm以方便盖上杯盖,冰中静置5分钟充分降温。
2.取-80℃保存的农杆菌感受态插入冰中5分钟,待其融化,加入0.01-1μg质粒DNA(体积不大于6ul,感受态转化效率较高,次使用前做预实验确定所加质粒的量),用手拨打管底混匀,立即插入冰中,用200μl枪头将感受态-质粒混合物快速移到电击杯中,盖上杯盖,空管保留待用。
3.启动电转仪,设置参数:C=25μF,PC=200 ohm,V=2400 V(此参数为Biorad推荐,使用者也可按所用电转仪推荐的protocol操作),将电击杯快速放入电转槽中,电击完成快速插入冰中,加入700μl无抗生素的LB并转移到感受态空管中,28℃振荡培养2~3小时。
4.6000 rpm离心一分钟收菌,留取100μl左右上清轻轻吹打重悬菌块涂布于含相应抗生素的LB或YEB平板上,倒置放于28℃培养箱培养2-3天(当平板只含有50μg/ml kan时,28℃培养48 h即可;平板中同时加入50μg/ml kan,20μg/ml rif时,需28℃培养60 h;如果使用的平板含有50μg/ml rif则需要28℃培养72-90 h)。
应用[7][8]
AGL1(pSoup)感受态细胞可用于外源基因GFP在白三叶草生物反应器系统中转录的研究:
目前,以植物作为生物反应器是一种生产高价值蛋白质的有效途径,并且已有大量证据表明植物生物反应器具有大规模生产高质量蛋白质的潜力。因此,对植物生物反应器的技术与策略进行深入研究是非常必要的。只有更详细地研究植物细胞内的RNA转录过程、转录子的稳定性、RNA结构以及蛋白质翻译的效率等因素,才能够在植物细胞内获得高水平表达的外源蛋白质。构建了两个表达载体,Double35S-GFP和-90-GFP。
在GFP编码区前面引入了一段具有很强功能的翻译启始保守序列,其中-3位的A和+4位的G符合Kozak consensus,-10 A则是能够特异性地提高白三叶细胞内蛋白质基因翻译效率的保守位点。同时两个新的酶切位点ClaI,XhoI也被引入到GFP的5‘UTR末端,以后将在此处插入新的功能序列以便研究UTR的二级结构对GFP表达的影响。
将这两个表达载体导入农杆菌,获得的农杆菌菌株AGL1pSoup-pG0020和AGL1pSoup-pG0023用来转化白三叶草叶片。优化试验显示,在实时PCR中,用来制作标准曲线的外参质粒Tubulin#2的工作浓度不能低于10 ag/ul;使用引物BADF159和BADR160扩增GFP的效果较好,其工作浓度均为300 nM;用于真空侵染的的工程菌的浓度越高,外源GFP在植物细胞中的表达水平就越高,因此OD600值为2.205作为农杆菌真空侵染的工作浓度。
利用携带有35S-GFP载体和-90-GFP载体的农杆菌对处于不同发育阶段的白三叶的叶片进行真空侵染。然后,我们对瞬时转录产物进行定量分析。实时PCR的分析结果表明不仅两个不同基因型的白三叶草叶片细胞中外源GFP的转录水平存在差异,而且即使是在同一个基因型中,不同的叶片之间转录水平也存在差异。
参考文献
[1]Molecular farming of recombinant antibodies in plants[J].S.Schillberg,R.Fischer,N.Emans.Cellular and Molecular Life Sciences.2003(3)
[2]A novel oxidative stress-inducible peroxidase promoter from sweetpotato:molecular cloning and characterization in transgenic tobacco plants and cultured cells[J].Kee-Yeun Kim,Suk-Yoon Kwon,Haeng-Soon Lee,Yunkang Hur,Jae-Wook Bang,Sang-Soo Kwak.Plant Molecular Biology.2003(6)
[3]Rhizosecretion of a monoclonal antibody protein complex from transgenic tobacco roots[J].Pascal M.W.Drake,Daniel M.Chargelegue,Nicholas D.Vine,Craig J.van Dolleweerd,Patricia Obregon,Julian K-C.Ma.Plant Molecular Biology.2003(1)
[4]Transgene integration,organization and interaction in plants[J].Ajay Kohli,Richard M.Twyman,Rita Abranches,Eva Wegel,Eva Stoger,Paul Christou.Plant Molecular Biology.2003(2)
[5]Chloroplast expression of His-tagged GUS-fusions:a general strategy to overproduce and purify foreign proteins using transplastomic plants as bioreactors[J].Sadhu Leelavathi,Vanga Siva Reddy.Molecular Breeding.2003(1)
[6]Overproduction of an alkali-and thermo-stable xylanase in tobacco chloroplasts and efficient recovery of the enzyme[J].Sadhu Leelavathi,Naveen Gupta,Shankar Maiti,Amit Ghosh,Vanga Siva Reddy.Molecular Breeding.2003(1)
[7]Chemical-Inducible,Ecdysone Receptor-Based Gene Expression System for Plants[J].Malla Padidam,Michael Gore,D.Lily Lu,Olga Smirnova.Transgenic Research.2003(1)
[8]肖乃仲.外源基因GFP在白三叶草生物反应器系统中转录的研究[D].东北师范大学,2005.
{9]The promoter–terminator of chrysanthemum rbcS1 directs very high expression levels in plants[J] . N. S. Outchkourov,J. Peters,J. de Jong,W. Rademakers,M. A. Jongsma. Planta . 2003 (6)
