四氢生物蝶呤
| 中文名称 | 四氢生物蝶呤 |
|---|---|
| 中文同义词 | 沙丙蝶呤;四氢生物蝶呤;四氢生物叠呤;沙普蝶呤;四氢生物蝶呤游离碱;[6R-[6R^<*>^(1R^<*>^,2S^<*>^)]]-2-氨基-6-(1,2-二羟丙基)-5,6,7,8-四氢-4(1H)-喋呤二酮;(6R)-BH4多少钱;化合物 T21366 |
| 英文名称 | (6R,S)-5,6,7,8-TETRAHYDRO-L-BIOPTERIN DIHYDROCHLORIDE |
| 英文同义词 | 4(1H)-PTERIDINONE, 2-AMINO-6-[(1R,2S)-1,2-DIHYDROXYPROPYL]-5,6,7,8-TETRAHYDRO-, (6R)-;2-amino-6-[(1R,2S)-1,2-dihydroxypropyl]-5,6,7,8-tetrahydro-4(1H)-Pteridinone;(6R)-5,6,7,8-Tetrahydrobiopterin;(6R,S)-5,6,7,8-TETRAHYDRO-L-BIOPTERIN DIHYDROCHLORIDE;(6R,S)-BH4 2HCL;(6R)-L-erythro-5,6,7,8-Tetrahydrobiopterin;(6R)-L-erythro-Tetrahydrobiopterin;(6R)-Tetrahydrobiopterin |
| CAS号 | 62989-33-7 |
| 分子式 | C9H15N5O3 |
| 分子量 | 241.25 |
| EINECS号 | 636-312-4 |
| 相关类别 | 医药中间体;其它药物;药物 |
| Mol文件 | 62989-33-7.mol |
| 结构式 | 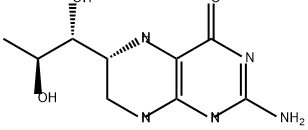 |
四氢生物蝶呤 性质
| 沸点 | 506.6±60.0 °C(Predicted) |
|---|---|
| 密度 | 1.89±0.1 g/cm3(Predicted) |
| 储存条件 | Keep in dark place,Sealed in dry,2-8°C |
| 酸度系数(pKa) | 5.05(at 25℃) |
四氢生物蝶呤(tetrahydrobiopterin,BH4)属于芳香族氨基酸羟化酶的辅酶,是一氧化氮合酶(nitric oxide synthase,NOS)三种同工酶-内皮型-氧化氮合酶(endothelial nitric oxide synthase,eNOS),神经元型一氧化氮合酶(neuronal nitric oxide synthase,nNOS)和诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)的辅因子。BH4在酶促反应中作为电子载体起还原剂的作用,是8个重要的加单氧酶的必需辅助因子,包括4个芳香族氨基酸羟化酶(AAAH)、3个NOS和1个烷基甘油加单氧酶(AGMO),并存在于高等动物每个细胞和组织参与多个生理和病理过程。AAAH包括苯丙氨酸羟化酶(PAH)、酪氨酸羟化酶(TH)和色氨酸羟化酶(TPH)。BH4氧化型为二氢生物蝶呤,后者在二氢生物蝶呤还原酶催化下以NADPH为供氢体还原再生成为四氢生物蝶呤。在正常生理状况下,BH4水平充足,NOS催化L-精氨酸产生一氧化氮(nitric oxide,NO),并参与下游部分通路的调节 BH4不仅参与NO的合成等许多生理过程,同时也参与如炎症血管内皮功能障碍糖尿病心血管疾病等病理过程;当其缺乏时,其催化产物是过氧化物,将导致以儿茶酚胺、血清素(单胺类神经递质)缺乏为病理生理特点,伴有或不伴有高苯丙氨酸血症的一系列罕见的遗传性神经系统疾病,可能导致高血压等一系列心血管活动的改变,并可能参与心脏肥厚、心脏结构重建和缺血/再灌注的病理和生理过程。治疗方法为单纯补充BH4或联合补充BH4、L-多巴卡比多巴和5-羟色氨酸。1.BH4与糖尿病
糖尿病中,BH4水平的下降与血管内皮功能障碍有着密切联系。BH4被氧化和eNOS脱偶联所导致的NO合成减少是血管内皮功能障碍的重要原因,同时eNOS脱偶联导致超氧化物的产生会加剧BH4的氧化。胰岛素有刺激活化eNOS的作用胰岛素与其血管内皮细胞的受体结合引起胰岛素受体底1(IRS-1)磷酸化,并随后通过PI3K /Akt的磷酸化激活eNOS 2型糖尿病Zucker大鼠模型中,可检测到PI3K /Akt系统的缺陷和NO生物利用度的下降。同时糖尿病引起的自主神经功能紊乱会导致内皮的NO生物利用度降低,加重内皮功能的障碍。在糖尿病时发生的上述改变,可导致eNOS的活性下降,NO合成或/和利用减少,致使血管内皮功能障碍,而血管内皮功能障碍会最终导致BH4水平下降,从而导致NO合成减少,再次加重血管内皮功能障碍,形成恶性循环许多研究致力于改善糖尿病所导致的血管内皮功能障碍。一些离体实验发现,用高糖处理自发性遗传糖尿病BB大鼠内皮细胞,会引起eNOS蛋白水平的增加,eNOS脱偶联和内皮功能障碍等,用墨蝶呤孵育细胞可起到恢复BH4水平从而恢复内皮细胞功能的作用;而用腺病毒将GTPCH转染至细胞内则可同样起到治疗作用。而一些在体实验表明过表GPTCH可促进BH4水平的增加,糖尿病血管内皮功能恢复,同时我们的工作证实过表达GPTCH也可改善内皮祖细胞功能,并促进1型糖尿病小鼠伤口愈合。近期研究还发现,将腺苷酸活化蛋白激酶(AMPK)的激活剂-二甲双胍给予链脲佐菌素诱导的1型糖尿病小鼠,可以降低由糖尿病引起的26S蛋白酶体对GTPCH的降解,抑制BH4水平的下降,同时二甲双胍还可以改善Ins2+ /Akita糖尿病小鼠内皮功能障碍等症状。综上所述,BH4的水平变化不是在糖尿病中导致血管内皮功能紊乱的唯一因素,而是由BH4 NO和PI3K /Akt通路以及一些其他的分子共同作用导致,并已发现包括直接给药诱导激活外界刺激等许多方法能够缓解内皮功能紊乱。
2.BH4与心肌保护
BH4在心肌保护方面扮演重要角色。在发生心脏负荷过重时,线粒体功能障碍诱导心肌细胞凋亡,并最终导致心肌肥厚和功能障碍。当给予BH4后可改善心肌功能 在小鼠心肌压力负荷模型中,即C57 /BL6小鼠主动脉弓缩窄4周后,心脏质量增加,舒张内径增加,心脏射血分数降至50%以下,引发NOS脱偶联和氧化应激,给予BH4可以抑制NOS脱偶联,抑制心肌纤维化,改善心室功能障碍。此外,BH4还可以预防缺血再灌注引起的损伤 研究表明,BH4可在缺血再灌注时阻止血管紧张素II浸入心肌,并阻止由此引起的心肌肥厚。BH4还可通过抑制NOS脱偶联,促进NO的合成,与激活的PI3K /Akt通路共同影响对心肌起保护作用的cGMP /PKG通路,抑制心肌的缺血再灌注损伤在离体实验中,使用BH4可以缓解心脏骤停所带来的心肌缺血再灌注损伤,而使用抗坏血酸和N-乙酰半胱氨酸维持BH4水平和BH4 /BH2比率,也可起到缓解心肌缺血再灌注损伤的作用。
3.BH4与肺动脉高压
肺动脉高压(PH)是一种以肺动脉肺静脉和肺毛细血管血压一同升高,并导致呼吸短促晕厥等症状的严重疾病,并伴有心力衰竭和运动耐受力下降。近年来研究发现BH4与肺动脉高压有着密切关系首先,研究发现BH4的氧化和消耗,会使eNOS的活性剂量依赖性地降低,同时在BH4水平较低时,Ang II可以降低DHFR的表达促进GTPCH的降解,导致肺动脉高压的发生。这说明,BH4缺乏与肺动脉高压有着联系。其次,研究者在eNOS基因敲除小鼠低氧诱导的肺动脉高压发生时,发现增加eNOS蛋白水平并不能增加NO的生物学活性;这说明肺动脉高压时BH4确实是缺乏的随后通过对缺氧性肺动脉高压易感的BH4合成缺乏的hph-1小鼠观察,发现增加内皮中BH4的合成可以阻止低氧诱导的肺动脉高压;这说明BH4可以抑制肺动脉高压的发生近期研究显示eNOS脱偶联和NADPH氧化酶的活性增加导致NO生物利用度下降,受损血管的修复再生能力减弱,在给予墨蝶呤后可以改善该种情况;提示BH4的减少所导致的NO生成减少和血管内皮功能的障碍是肺动脉高压发生的途径之一,并且在补充BH4后可以缓解该情况。
4.BH4与高胆固醇血症
eNOS产生的NO是一种抗血栓形成和抗动脉粥样硬化的分子。在高胆固醇血症发生时,NADPH氧化酶介导的氧化应激导致BH4的氧化,eNOS功能障碍和活性降低,并导致血管NO的生物利用度的降低,最终参与诱导动脉粥样硬化形成 目前人们已经使用多种方法证明高胆固醇血症中BH4的缺乏所导致的NO产生减少导致动脉粥样硬化发生无论是通过ApoE-KO小鼠和ApoE-KO /TgGCH小鼠模型,还是通过血流介导的血管舒张功能检测,或是通过BH4直接给药的方法,都发现给予BH4可以维持NOS的偶联状态,降低氧化应激,保护血管内皮的功能,减缓动脉粥样硬化的发展血管紧张素转换酶抑制剂AT1 受体拮抗药他汀类药物奈必洛尔和白藜芦醇等药物及活性化合物已被证明可以抑制eNOS的脱偶联,并同时增强eNOS活性。
5.BH4与生物节律性
研究显示BH4以及GTPCH在体内的表达水平也存在着节律性 当节律基因如Bmal1和Per2失活时,小鼠的血管内皮细胞功能将会受到明显抑制,引起O2 的累积和血管正常舒张功能的减弱,主要原因可能是BH4昼夜节律性失调和表达水平紊乱而导致eNOS的脱偶联同时,研究发现,环氧酶非选择性抑制剂吲哚美辛可以一定程度上缓解Bmal1基因失活导致的血管内皮细胞功能抑制,但是对于Per2基因失活所引起的血管内皮细胞功能抑制没有缓解效果,原理目前尚不清楚。
6.辅助BH4的利用
BH4的不稳定性使得其应用的推广并不顺利,随着对BH4利用的研究不断深入,一些新的思路涌现出来:1)使用叶酸:叶酸可以增加BH4和eNOS的结合紧密度,促进BH2向BH4的转化,稳定BH4;2)使用5-甲基四氢叶酸:5-甲基四氢叶酸可以模仿BH4的定位,并可以与NOS的活性位点紧密结合,达到模仿BH4生理作用的作用;3)使用维生素C:维生素C作为还原剂可以直接降低血管系统的氧化应激,还可以通过稳定BH4的化学结构,升高BH4细胞内水平,使得eNOS的活性增强。
7.BH4与高血压
BH4可改善内皮依赖性血管舒张功能,使内皮依赖性血管舒张明显改善,高血压进展延缓;还可以保护内皮祖细胞(EPC)功能。长期外源性补充BH4可明显抑制SHR的高血压进展,机制包括直接增加eNOS源性一氧化氮间接减少O2-,生成抗氧化活性保护内皮功能等。BH4可通过从头合成和补救途径两条途径在细胞的胞浆内合成。在生理条件下,I 型三磷酸鸟苷环化水解酶(GTP cyclohydrolase I,GTPCH)是BH4从头合成的限速酶,该酶催化三磷酸鸟苷(guanosine triphosphate,GTP)形成7,8-三磷酸二氢新蝶呤(7,8-dihydroneopterinTriphosphate),随后被6-丙酮四氢蝶呤合成酶(6-pyruvoyl -tetrahydropterin synthase,PTPS)转化为6 -丙酮-5,6,7,8-四氢蝶呤,最后在墨蝶呤还原酶(sepiapterin reductase,SR)的作用下被还原为BH4。
BH4也可通过补救途径合成:即在墨蝶呤还原酶的作用下,以墨蝶呤为底物转化为7,8-二氢生物蝶呤(7,8-Dihydrobiopterin,BH2),再进一步被二氢叶酸还原酶(dihydrofolate reductase,DHFR)还原为BH4,而2,4-二氨基-6-羟基嘧啶(2,4-Diamino-6-hydroxypyrimidin,DAHP)和N-乙酰-5-羟色氨(Nacetylserotonin,NAS)分别为GTPCH和墨蝶呤还原酶的抑制剂,能够阻断BH4的合成。

图1为四氢生物蝶呤生物合成的两条途径( 从头合成和补救途径)
从头合成途径( 右侧) 从GTP 起经过3 个步骤合成至BH4,由GCH1 基因所编码的I 型三磷酸鸟苷环化水解酶( GTPCH) 限制其合成速率。BH4 也可经过补救措施( 左侧) 从墨蝶呤起经过2 个步骤合成BH4 缺乏症是一种极少见的常染色体隐性遗传代谢病。其特点是血 Phe 增高及进行性神经系统症状,即使用低 Phe饮食将血 Phe 控制在正常范围仍无法改善症状。这是因为 BH4 不仅是苯丙氨酸羟化酶的辅因子,BH4 缺乏损害3种芳香族氨基酸羟化反应,而导致脑内神经递质左旋多巴和 5-羟色胺的生成减少。除造成高苯丙氨酸血症(HPA)外,还影响到脑细胞中髓鞘蛋白的合成,造成神经介质的减少。BH4 缺乏症占总 HPA 的比例存在地区差异,高加索人中 1 .5 %~2%的 HPA 为 BH4 缺乏症;沙特阿拉伯为66 %。
1. 表现:由于患者存在 HPA,故晚治患儿有经典型疹、鼠尿味等,除此之外,BH4 缺乏症突出的临床表现是肌张力低下和难以控制的抽搐。早期正规的低 phe 饮食治疗后,血 phe 控制在理想范围,但上述神经系统症状未趋向好转 , 且进行性加重。故临床医生应高度警惕是否为 BH4 缺乏症,并给予相应的实验室检查。新生儿筛查发现的HPA患儿,因早期临床表现不典型,难与BH4缺乏症相鉴别,故也应做实验室检查以协助诊断。BH4 缺乏症的临床表现具有高度异质性,故又分为 3 种类型:① 中枢型,以脑脊液中神经递质代谢产物的浓度低和严重的神经系统症状为特征;② 周围型(温和型),脑脊液中神经递质代谢产物的水平正常;③ 短暂型,表现为一过性的新生儿 HPA。中枢型患者表现为躯干、 四肢肌张力低下,双上肢内旋。婴儿出现抬头困难,吸吮力低下,吞咽困难,至幼儿或儿童期表现为软弱无力、眼睑下垂、嗜睡、反应极差、激惹、口水增多,难以控制的抽搐,不明原因的高热,严重的发育迟缓。
2. BH4 缺乏症的诊断及治疗:尿蝶呤分析是BH4 缺乏症常用的筛查方法。BH4负荷试验是临床上较可靠而迅速的鉴别诊断方法。BH4 缺乏者在补充 BH4 后苯丙氨酸羟化酶活性恢复正常,血 Phe很快下降。而经典型PKU因苯丙氨酸羟化酶缺乏,故对BH4无反应。对血Phe 增高的患儿应同时做尿蝶呤分析和 BH4 负荷试验,以明确诊断、及早治疗,阻止神经系统损害症状的发生。治疗越早,神经系统症状得到改善越早,预后越好。
一经诊断应立即给予BH4和神经递质前质多巴(L-DOPA),5-羟色氨酸 (5-HTP)联合治疗。每日口服BH42~5mg/kg以控制血Phe浓度达正常水平; DHPR缺乏者BH4量更大些。给予L-DOPA 5~15 mg/kg·d和5-HTP 3~ 13mg/kg·d以改善神经系统症状,L-DOPA和5-HTP药物开始治疗剂量从 1mg/kg·d,每周逐渐增加1mg/kg,至治疗剂量,并将总量分3~4次。多巴制剂有息宁和美多巴,每片含左旋多巴200 mg。定期进行生长和智能发育评价。由于个体适应性不同,药物开始剂量宜小,约 3~4 周后达到足够剂量。同时注意用药期间仍需严格控制血 Phe 浓度,因为血Phe浓度不稳定会影响治疗效果。另外需注意观察药物的副作用如皮疹等。
有关四氢生物蝶呤的芳香族氨基酸羟化酶的辅酶、生物学功能、生物合成 、四氢生物蝶呤缺乏与治疗是由Chemicalbook的王旭艳编辑整理。(2016-6-13)
二盐酸沙丙蝶呤(Sapropterin Dihydrochloride):C9H15N5O3?2HCl。[69056-38-8]。白色结晶或结晶性粉末,无臭,味略酸。极易溶于水,较难溶于甲醇,极难溶于乙醇,几不溶于乙醚。熔点245~246℃(分解)。[α]D25-6.81。(C=0.665,0.1mol/L盐酸)。UV最大吸收(2mol/L盐酸):264nm(ε16770)。
糖尿病中,BH4水平的下降与血管内皮功能障碍有着密切联系。BH4被氧化和eNOS脱偶联所导致的NO合成减少是血管内皮功能障碍的重要原因,同时eNOS脱偶联导致超氧化物的产生会加剧BH4的氧化。胰岛素有刺激活化eNOS的作用胰岛素与其血管内皮细胞的受体结合引起胰岛素受体底1(IRS-1)磷酸化,并随后通过PI3K /Akt的磷酸化激活eNOS 2型糖尿病Zucker大鼠模型中,可检测到PI3K /Akt系统的缺陷和NO生物利用度的下降。同时糖尿病引起的自主神经功能紊乱会导致内皮的NO生物利用度降低,加重内皮功能的障碍。在糖尿病时发生的上述改变,可导致eNOS的活性下降,NO合成或/和利用减少,致使血管内皮功能障碍,而血管内皮功能障碍会最终导致BH4水平下降,从而导致NO合成减少,再次加重血管内皮功能障碍,形成恶性循环许多研究致力于改善糖尿病所导致的血管内皮功能障碍。一些离体实验发现,用高糖处理自发性遗传糖尿病BB大鼠内皮细胞,会引起eNOS蛋白水平的增加,eNOS脱偶联和内皮功能障碍等,用墨蝶呤孵育细胞可起到恢复BH4水平从而恢复内皮细胞功能的作用;而用腺病毒将GTPCH转染至细胞内则可同样起到治疗作用。而一些在体实验表明过表GPTCH可促进BH4水平的增加,糖尿病血管内皮功能恢复,同时我们的工作证实过表达GPTCH也可改善内皮祖细胞功能,并促进1型糖尿病小鼠伤口愈合。近期研究还发现,将腺苷酸活化蛋白激酶(AMPK)的激活剂-二甲双胍给予链脲佐菌素诱导的1型糖尿病小鼠,可以降低由糖尿病引起的26S蛋白酶体对GTPCH的降解,抑制BH4水平的下降,同时二甲双胍还可以改善Ins2+ /Akita糖尿病小鼠内皮功能障碍等症状。综上所述,BH4的水平变化不是在糖尿病中导致血管内皮功能紊乱的唯一因素,而是由BH4 NO和PI3K /Akt通路以及一些其他的分子共同作用导致,并已发现包括直接给药诱导激活外界刺激等许多方法能够缓解内皮功能紊乱。
2.BH4与心肌保护
BH4在心肌保护方面扮演重要角色。在发生心脏负荷过重时,线粒体功能障碍诱导心肌细胞凋亡,并最终导致心肌肥厚和功能障碍。当给予BH4后可改善心肌功能 在小鼠心肌压力负荷模型中,即C57 /BL6小鼠主动脉弓缩窄4周后,心脏质量增加,舒张内径增加,心脏射血分数降至50%以下,引发NOS脱偶联和氧化应激,给予BH4可以抑制NOS脱偶联,抑制心肌纤维化,改善心室功能障碍。此外,BH4还可以预防缺血再灌注引起的损伤 研究表明,BH4可在缺血再灌注时阻止血管紧张素II浸入心肌,并阻止由此引起的心肌肥厚。BH4还可通过抑制NOS脱偶联,促进NO的合成,与激活的PI3K /Akt通路共同影响对心肌起保护作用的cGMP /PKG通路,抑制心肌的缺血再灌注损伤在离体实验中,使用BH4可以缓解心脏骤停所带来的心肌缺血再灌注损伤,而使用抗坏血酸和N-乙酰半胱氨酸维持BH4水平和BH4 /BH2比率,也可起到缓解心肌缺血再灌注损伤的作用。
3.BH4与肺动脉高压
肺动脉高压(PH)是一种以肺动脉肺静脉和肺毛细血管血压一同升高,并导致呼吸短促晕厥等症状的严重疾病,并伴有心力衰竭和运动耐受力下降。近年来研究发现BH4与肺动脉高压有着密切关系首先,研究发现BH4的氧化和消耗,会使eNOS的活性剂量依赖性地降低,同时在BH4水平较低时,Ang II可以降低DHFR的表达促进GTPCH的降解,导致肺动脉高压的发生。这说明,BH4缺乏与肺动脉高压有着联系。其次,研究者在eNOS基因敲除小鼠低氧诱导的肺动脉高压发生时,发现增加eNOS蛋白水平并不能增加NO的生物学活性;这说明肺动脉高压时BH4确实是缺乏的随后通过对缺氧性肺动脉高压易感的BH4合成缺乏的hph-1小鼠观察,发现增加内皮中BH4的合成可以阻止低氧诱导的肺动脉高压;这说明BH4可以抑制肺动脉高压的发生近期研究显示eNOS脱偶联和NADPH氧化酶的活性增加导致NO生物利用度下降,受损血管的修复再生能力减弱,在给予墨蝶呤后可以改善该种情况;提示BH4的减少所导致的NO生成减少和血管内皮功能的障碍是肺动脉高压发生的途径之一,并且在补充BH4后可以缓解该情况。
4.BH4与高胆固醇血症
eNOS产生的NO是一种抗血栓形成和抗动脉粥样硬化的分子。在高胆固醇血症发生时,NADPH氧化酶介导的氧化应激导致BH4的氧化,eNOS功能障碍和活性降低,并导致血管NO的生物利用度的降低,最终参与诱导动脉粥样硬化形成 目前人们已经使用多种方法证明高胆固醇血症中BH4的缺乏所导致的NO产生减少导致动脉粥样硬化发生无论是通过ApoE-KO小鼠和ApoE-KO /TgGCH小鼠模型,还是通过血流介导的血管舒张功能检测,或是通过BH4直接给药的方法,都发现给予BH4可以维持NOS的偶联状态,降低氧化应激,保护血管内皮的功能,减缓动脉粥样硬化的发展血管紧张素转换酶抑制剂AT1 受体拮抗药他汀类药物奈必洛尔和白藜芦醇等药物及活性化合物已被证明可以抑制eNOS的脱偶联,并同时增强eNOS活性。
5.BH4与生物节律性
研究显示BH4以及GTPCH在体内的表达水平也存在着节律性 当节律基因如Bmal1和Per2失活时,小鼠的血管内皮细胞功能将会受到明显抑制,引起O2 的累积和血管正常舒张功能的减弱,主要原因可能是BH4昼夜节律性失调和表达水平紊乱而导致eNOS的脱偶联同时,研究发现,环氧酶非选择性抑制剂吲哚美辛可以一定程度上缓解Bmal1基因失活导致的血管内皮细胞功能抑制,但是对于Per2基因失活所引起的血管内皮细胞功能抑制没有缓解效果,原理目前尚不清楚。
6.辅助BH4的利用
BH4的不稳定性使得其应用的推广并不顺利,随着对BH4利用的研究不断深入,一些新的思路涌现出来:1)使用叶酸:叶酸可以增加BH4和eNOS的结合紧密度,促进BH2向BH4的转化,稳定BH4;2)使用5-甲基四氢叶酸:5-甲基四氢叶酸可以模仿BH4的定位,并可以与NOS的活性位点紧密结合,达到模仿BH4生理作用的作用;3)使用维生素C:维生素C作为还原剂可以直接降低血管系统的氧化应激,还可以通过稳定BH4的化学结构,升高BH4细胞内水平,使得eNOS的活性增强。
7.BH4与高血压
BH4可改善内皮依赖性血管舒张功能,使内皮依赖性血管舒张明显改善,高血压进展延缓;还可以保护内皮祖细胞(EPC)功能。长期外源性补充BH4可明显抑制SHR的高血压进展,机制包括直接增加eNOS源性一氧化氮间接减少O2-,生成抗氧化活性保护内皮功能等。BH4可通过从头合成和补救途径两条途径在细胞的胞浆内合成。在生理条件下,I 型三磷酸鸟苷环化水解酶(GTP cyclohydrolase I,GTPCH)是BH4从头合成的限速酶,该酶催化三磷酸鸟苷(guanosine triphosphate,GTP)形成7,8-三磷酸二氢新蝶呤(7,8-dihydroneopterinTriphosphate),随后被6-丙酮四氢蝶呤合成酶(6-pyruvoyl -tetrahydropterin synthase,PTPS)转化为6 -丙酮-5,6,7,8-四氢蝶呤,最后在墨蝶呤还原酶(sepiapterin reductase,SR)的作用下被还原为BH4。
BH4也可通过补救途径合成:即在墨蝶呤还原酶的作用下,以墨蝶呤为底物转化为7,8-二氢生物蝶呤(7,8-Dihydrobiopterin,BH2),再进一步被二氢叶酸还原酶(dihydrofolate reductase,DHFR)还原为BH4,而2,4-二氨基-6-羟基嘧啶(2,4-Diamino-6-hydroxypyrimidin,DAHP)和N-乙酰-5-羟色氨(Nacetylserotonin,NAS)分别为GTPCH和墨蝶呤还原酶的抑制剂,能够阻断BH4的合成。

图1为四氢生物蝶呤生物合成的两条途径( 从头合成和补救途径)
从头合成途径( 右侧) 从GTP 起经过3 个步骤合成至BH4,由GCH1 基因所编码的I 型三磷酸鸟苷环化水解酶( GTPCH) 限制其合成速率。BH4 也可经过补救措施( 左侧) 从墨蝶呤起经过2 个步骤合成BH4 缺乏症是一种极少见的常染色体隐性遗传代谢病。其特点是血 Phe 增高及进行性神经系统症状,即使用低 Phe饮食将血 Phe 控制在正常范围仍无法改善症状。这是因为 BH4 不仅是苯丙氨酸羟化酶的辅因子,BH4 缺乏损害3种芳香族氨基酸羟化反应,而导致脑内神经递质左旋多巴和 5-羟色胺的生成减少。除造成高苯丙氨酸血症(HPA)外,还影响到脑细胞中髓鞘蛋白的合成,造成神经介质的减少。BH4 缺乏症占总 HPA 的比例存在地区差异,高加索人中 1 .5 %~2%的 HPA 为 BH4 缺乏症;沙特阿拉伯为66 %。
1. 表现:由于患者存在 HPA,故晚治患儿有经典型疹、鼠尿味等,除此之外,BH4 缺乏症突出的临床表现是肌张力低下和难以控制的抽搐。早期正规的低 phe 饮食治疗后,血 phe 控制在理想范围,但上述神经系统症状未趋向好转 , 且进行性加重。故临床医生应高度警惕是否为 BH4 缺乏症,并给予相应的实验室检查。新生儿筛查发现的HPA患儿,因早期临床表现不典型,难与BH4缺乏症相鉴别,故也应做实验室检查以协助诊断。BH4 缺乏症的临床表现具有高度异质性,故又分为 3 种类型:① 中枢型,以脑脊液中神经递质代谢产物的浓度低和严重的神经系统症状为特征;② 周围型(温和型),脑脊液中神经递质代谢产物的水平正常;③ 短暂型,表现为一过性的新生儿 HPA。中枢型患者表现为躯干、 四肢肌张力低下,双上肢内旋。婴儿出现抬头困难,吸吮力低下,吞咽困难,至幼儿或儿童期表现为软弱无力、眼睑下垂、嗜睡、反应极差、激惹、口水增多,难以控制的抽搐,不明原因的高热,严重的发育迟缓。
2. BH4 缺乏症的诊断及治疗:尿蝶呤分析是BH4 缺乏症常用的筛查方法。BH4负荷试验是临床上较可靠而迅速的鉴别诊断方法。BH4 缺乏者在补充 BH4 后苯丙氨酸羟化酶活性恢复正常,血 Phe很快下降。而经典型PKU因苯丙氨酸羟化酶缺乏,故对BH4无反应。对血Phe 增高的患儿应同时做尿蝶呤分析和 BH4 负荷试验,以明确诊断、及早治疗,阻止神经系统损害症状的发生。治疗越早,神经系统症状得到改善越早,预后越好。
一经诊断应立即给予BH4和神经递质前质多巴(L-DOPA),5-羟色氨酸 (5-HTP)联合治疗。每日口服BH42~5mg/kg以控制血Phe浓度达正常水平; DHPR缺乏者BH4量更大些。给予L-DOPA 5~15 mg/kg·d和5-HTP 3~ 13mg/kg·d以改善神经系统症状,L-DOPA和5-HTP药物开始治疗剂量从 1mg/kg·d,每周逐渐增加1mg/kg,至治疗剂量,并将总量分3~4次。多巴制剂有息宁和美多巴,每片含左旋多巴200 mg。定期进行生长和智能发育评价。由于个体适应性不同,药物开始剂量宜小,约 3~4 周后达到足够剂量。同时注意用药期间仍需严格控制血 Phe 浓度,因为血Phe浓度不稳定会影响治疗效果。另外需注意观察药物的副作用如皮疹等。
有关四氢生物蝶呤的芳香族氨基酸羟化酶的辅酶、生物学功能、生物合成 、四氢生物蝶呤缺乏与治疗是由Chemicalbook的王旭艳编辑整理。(2016-6-13)
化学性质
Pk’5.05。UV最大吸收(0.1mol/L盐酸):265nm(ε14000)。二盐酸沙丙蝶呤(Sapropterin Dihydrochloride):C9H15N5O3?2HCl。[69056-38-8]。白色结晶或结晶性粉末,无臭,味略酸。极易溶于水,较难溶于甲醇,极难溶于乙醇,几不溶于乙醚。熔点245~246℃(分解)。[α]D25-6.81。(C=0.665,0.1mol/L盐酸)。UV最大吸收(2mol/L盐酸):264nm(ε16770)。
用途
可引起多巴胺释放。用于识别障碍。生产方法
往水中加入L-赤式-生蝶呤(Biopterin,[22150-76-1])和铂黑,再用四乙铵氢氧化物调至Ph值12。然后-5℃或以下和9.81MPa的氢压下催化氢化,结束后加入盐酸,得到二盐酸沙丙蝶呤,收率85%。| 提供商 | 语言 |
|---|---|
|
英文
|
上游原料
