Аминокислоты представляют собой основные соединения белков, представляющие собой карбоксилаты, содержащие аминогруппы в молекулах. В природе существует более 200 видов аминокислот. Но количество аминокислот, составляющих организм животного и его белковый продукт, составляет всего 20.
Структура и классификация аминокислот
Структура и классификация аминокислот
структура аминокислоты: аминокислоты, полученные в результате гидролиза белка, представляют собой в основном α-аминокислоту с α-атомом углерода, близким к карбоксильной группе, связанной с аминогруппой (-NH2 в), карбоксильную группу (- COOH), атом водорода и группа боковой цепи. Боковая цепь может быть обозначена буквой R, разные R ведут к разным аминокислотам; основная структура аминокислотной формулы выглядит следующим образом:
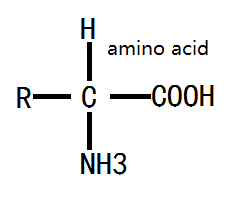
Рисунок 1: основная формула аминокислоты.
Классификация аминокислот в соответствии с полярностью R, аминокислоты можно классифицировать на неполярные аминокислоты группы R, незаряженные полярные группы R амино кислоты и положительно заряженных аминокислот и отрицательно заряженных аминокислот R-группы. К первой категории относятся аланин, лейцин, изолейцин, валин, пролин, фенилаланин и метионин; ко второй категории относятся глицин, серин, треонин, цистеин и казеиновая кислота; к третьей категории относятся лизин, аргинин и треонин; четвертая категория включает аспарагиновую кислоту и глутаминовую кислоту.
В животноводстве, согласно различным методам классификации, аминокислоты можно разделить на незаменимые аминокислоты и заменимые аминокислоты, ограничивающие аминокислоты и не ограничивающие аминокислоты. кислоты.
Изомер: кроме глицина (для которого группа R представляет собой атом водорода), альфа-углероды всех остальных аминокислот [альфа] представляют собой асимметричный углерод атомов, таким образом, имея стереоизомеры и, следовательно, будучи оптически активными. По конфигурации α-углеродного атома аминокислоты можно разделить на L-тип и D-тип. Все аминокислоты, образующиеся в результате протеолиза животных и растений, относятся к L-типу. Аминокислоты, полученные путем химического синтеза и ферментации, содержат L-аминокислоты, D-аминокислоты и DL-аминокислоты в виде смеси равных количеств L- и D-типа. Ферментативная система животных может напрямую использовать L-аминокислоту только для синтеза белка в тканях. Помимо метионина, D-аминокислоты и DL-аминокислоты имеют очень низкую эффективность утилизации и даже не могут быть использованы животными.
Общие свойства аминокислот
Физические свойства природная аминокислота представляет собой бесцветный кристаллический материал с относительно высокой температурой плавления, обычно превышающей 200 ℃. Обычно растворим в воде, нерастворим в неполярных органических растворителях. Однако тирозин и цистин нерастворимы в воде; пролин и карбоновый пролин можно растворить в этаноле и эфире. Все виды аминокислот растворимы в растворах кислот и щелочей.
Кислотность и щелочность аминокислот аминокислоты являются амфотерными электролитами, способными образовывать соли с кислотой или основанием. Карбоксильная группа и аминогруппа в одной и той же молекуле также могут образовывать внутренние соли. В растворе аминокислота находится в основном в ионной форме. Если мы отрегулируем pH раствора определенной аминокислоты, чтобы он стал непроводящим, чтобы ионы не двигались ни к катоду, ни к аноду, pH раствора в этом случае называется изоэлектрической точкой этой аминокислоты и т. д.
Химические реакции, связанные с определением аминокислот
(1) Реакция с азотистой кислотой; аминокислоты могут взаимодействовать с нитратами с образованием оксикислоты и воды и количественным выделением азота.
(2) Реакция с 2,4-нитрофторбензолом; в условиях, близких к нейтральным или слабощелочным, при комнатной температуре аминогруппа внутри молекулы аминокислоты может реагировать с 2,4-нитрофторбензолом с образованием 2,4-нитрофторбензольных производных аминокислот, т. е. желтого ДНФ. - аминокислоты.
(3) Реакция с диметиламино-нафталинсульфонилхлоридом (DNS-CL); флуоресцентный реагент DNS-CL может связываться с аминогруппой аминокислот с образованием флуоресцентной аминокислоты DNS в DNS. Лизин, гистидин, аспарагиновая кислота, тирозин и другие аминокислоты могут образовывать пары производных DNS-аминокислота со стабильными свойствами.
(4) Реакция с нингидрином; α-Аминокислота может быть окислена и разложена нингидрином до альдегида, аммиака и CO2, при этом нингидрин будет восстановлен. Высвобожденный аммиак может вступить в реакцию конденсации с другой молекулой нингидрина и одной молекулой продукта восстановления нингидрина с образованием соединения сине-фиолетового цвета.
Разделение и определение аминокислот; аминокислоты – это в основном связанные аминокислоты; первый этап разделения аминокислот заключается в использовании кислоты или основания для гидролиза белка, приготовлении смеси аминокислот, затем выполняется распределительная хроматография и ионообменная хроматография для дальнейшего разделения и определения аминокислот.