7783-06-4
中文名称
氢硫酸
英文名称
Hydrogen Sulfide
CAS
7783-06-4
EINECS 编号
231-977-3
分子式
H2S
MDL 编号
MFCD00011444
分子量
34.08
MOL 文件
7783-06-4.mol
更新日期
2025/04/26 19:10:32
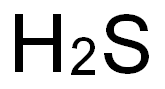 7783-06-4 结构式
7783-06-4 结构式
基本信息
中文别名
硫化氢硫化氢(>99.5%)
氢硫酸
硫化氢(液体)
硫氢化合物
液体硫化氢
英文别名
H2SHYDROGEN SULFIDE
HYDROGEN SULFIDE, SOLID
HYDROGEN SULFIDE WATER
HYDROGEN SULFIDE WATER, SAT
HYDROGEN SULPHIDE
Acide sulfhydrique
acidesulfhydrique
acidesulfhydrique(french)
acidesulphhydrique
Dihydrogen monosulfide
Dihydrogen sulfide
dihydrogenmonosulfide
dihydrogensulfide
Hepatic acid
Hepatic gas
Hydrogen monosulfide
Hydrogen sulfide (H2S)
Hydrogene sulfure
hydrogenesulfure
所属类别
无机化工产品: 无机盐: Co硫化物及硫酸盐物理化学性质
外观性质无色、有恶臭的气体。
外观性状无色、有臭鸡蛋样恶臭味的酸性气体。相对密度1.5392(0℃)。熔点85.5℃。沸点-60.3℃。临界温度100.5℃。临界压力9.0×103Pa。汽化热18.67 kJ/mol;熔化热23.80 kJ/mol。蒸气压2.7 kPa(25.5℃)。蒸气相对密度1.19。燃点260℃。爆炸极限:下限为4.3%(体积),上限为40.0%(体积)。在空气中的容许浓度为10×10-6(ppm)。溶于水、乙醇、甘油、二硫化碳。在有机胺中溶解度极大。在苛性碱溶液中也有较大的溶解度。在过量氧气中燃烧生成二氧化硫和水,当氧气供应不足时生成水与游离硫。室温下稳定。
溶解性溶于水、乙醇。
熔点−85 °C(lit.)
沸点−60 °C(lit.)
密度dgas 1.19 (air = 1.00)
蒸气密度1.19 (15 °C, vs air)
蒸气压252 psi ( 21 °C)
闪点-17℃
储存条件2-8°C
溶解度soluble in H2O
酸度系数(pKa)7(at 25℃)
形态无色气体
颜色colorless gas; flammable
Flame ColorBlue
PH值pKa1= 6.90, pKa2 = 13.48(25℃)
气味 (Odor)Strong rotten egg odor detectable at 0.001 to 0.1 ppm (mean = 0.0094 ppm);
olfactory fatigue occurs quickly at high concentrations
爆炸极限值(explosive limit)6%
嗅觉阈值(Odor Threshold)0.00041ppm
水溶解性1g dissolves in H2O: 187mL (10°C), 242mL (20°C), 314 (30°C) [MER06]
Merck13,4823
BRN3535004
Dielectric constant9.3(-84℃)
介电常数9.3(-84℃)
稳定性稳定的。高度易燃。可能与空气形成爆炸性混合物。注意广泛的爆炸极限。与强氧化剂、许多金属不相容。可能与金属氧化物、铜、氟、钠、乙醇发生剧烈反应。
EPA化学物质信息Hydrogen sulfide (7783-06-4)
安全数据
警示词危险
危险性描述H220-H280-H330-H400
危险品标志F+,T+,N
危险类别码R12-R26-R50
危险品运输编号UN 1053 2.3
职业暴露限值Ceiling: 10 ppm (15 mg/m3) [10-minute]
WGK Germany2
RTECS号MX1225000
自燃温度260 °C
DOT Classification2.3, Hazard Zone B (Gas poisonous by inhalation)
危险等级2.3
立即威胁生命和健康浓度100 ppm
应用领域
用途一
可用于转化硫黄和硫酸,生产硫化钠和硫氢化钠,或用于生产有机硫化合物如噻吩、硫醇和硫醚等用途二
用于分离和鉴定金属离子、精制盐酸和硫酸、制元素硫用途三
用于合成荧光粉,电放光、光导体、光电曝光计等的制造。有机合成还原剂。用于金属精制、农药、医药、催化剂再生。通用试剂。制取各种硫化物。参考质量标准
参考标准▼
▲
指标名称
指标
含量(H2S,液相)/%≥
99.0
氮(N2)/%<
0.007
氧(O2)
%<0.003
水分(H2O)/%<
0.003
烯烃(CnHm)/%<
0.1
外观
无色、有恶臭、有毒的酸性气体
7783-06-4(安全特性,毒性,储运)
爆炸物危险特性
与空气混合易爆储运特性
库房通风低温干燥; 与硝酸、强氧化剂分开存放毒性分级
中毒急性毒性
吸入-大鼠LC50:666毫克/立方米;吸入-小鼠LC50:951毫克/立方米/1小时可燃性危险特性
易燃; 燃烧产生有毒氮氧化物烟雾类别
有害气体灭火剂
雾状水、砂土、泡沫职业标准
TWA 15 毫克/立方米; STEL 23 毫克/立方米常见问题列表
硫化氢
硫化氢是硫的氢化物,化学式为H2S。一种无色、有恶臭味(臭鸡蛋味)的剧毒气体。能溶于水和乙醇,比重为1.1906。熔点-85.5°C,沸点-60.4°C,临界温度100.4°C,临界压力90.06×105帕。自燃点为260°C,具有可燃性,遇火星能引起爆炸燃烧,与空气相混时,能引发爆炸,爆炸极限为4%~44%(体积)。能与多种离子起化学作用,生成不溶于水的硫化物,能使铜、银表面变黑。广泛存在于金属冶炼、天然气 、盐酸和硫酸等的制造工业中。在制造硫酸盐纸浆、人造丝、人造棉、橡胶、二硫化碳等各种硫化物时,常有硫化氢气体排出。在一些化学反应中,含硫化合物不稳定也会分解出硫化氢,如:炼焦、精制石油及金属冶炼中,硫化氢作为一种常规废气,极易泄漏到空气中。硫化染料分解也可放出硫化氢气体。
硫化氢在水中电离,是个二元弱酸, 称为氢硫酸:
图1:硫化氢在水中电离生产氢硫酸
在空气中, 氢硫酸能被氧逐渐氧化, 析出硫磺而变混浊故必须在使用前临时配制。硫化氢化学性质不稳定,加热时会分解为氢和硫。在空气中燃烧, 生成水和二氧化硫。在不足的空气中燃烧, 可得到单质硫。硫化氢中的硫易于给出电子, 所以它是一种很好的还原剂。如在酸性介质中, 它能将Fe3+还原成Fe2+, 将Br2还原成Br-, 将MnO-4还原为Mn2+,将Cr2O2-7还原成Cr3+,将HNO3还原成NO2等,而硫化氢则被氧化成单质硫或亚硫酸盐或硫酸盐。在潮湿的空气中硫化氢和SO2反应生成单质硫 (歧化反应的逆反应)。硫化氢能使银、铜等制品表面变黑, 与许多金属离子作用, 生成不溶于水或酸的硫化物沉淀。在实验室中常用于分离、鉴定金属离子。硫化氢在实验室中常用FeS与稀盐酸作用来制取。氢与硫只在加热时才反应生成硫化氢。
水中溶解度(g/100ml)
每100毫升水中的溶解克数:0.33g/20℃
毒性
有毒!主要经呼吸道吸收而引起全身中毒,是一种化学性窒息性气体。接触浓度超过700×10-6时产生急性中毒。如不及时救治,就会死亡。低浓度气体能刺激呼吸器官和眼睛,还有头痛、眩晕、虚弱等症状。出现咳嗽、结膜炎。操作时必须穿戴包括氧气防毒面具的全身防护服。对吸入蒸气的患者脱离污染区,安置在空气新鲜的地方并保暖。严重者须就医诊治。如果呼吸停止,须立即进行人工呼吸。眼睛受刺激须用大量水冲洗,并就医诊治。


