背景及概述[1]
6-溴-4-羟基吡唑并[1,5-A]吡啶-3-甲腈是一种医药中间体,可用于制备RET抑制剂。6-溴-4-羟基吡唑并[1,5-A]吡啶-3-甲腈可由6-溴-4-甲氧基吡唑并[1,5-a]吡啶-3-甲腈脱去甲基后得到。
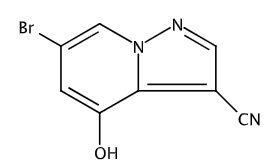
制备[1-2]
报道一、
室温条件下,在1L单口瓶中依次加6-溴-4-甲氧基吡唑并[1,5-a]吡啶-3-甲腈(50g,198.36mmol),水(16.5mL,916mmol),氢氧化钠(16.03g,396.8mmol),DMAC(500mL),室温搅拌5min后转入0℃缓慢加入十二硫醇(97mL,397mmol),加料结束后,反应转入45℃过夜。将反应液倒入3L冰水中,缓慢加入饱和柠檬酸水溶液调节PH=5,搅拌半小时后静置,过滤,滤饼用水和石油醚多次洗涤,60℃烘干得到黄色固体44.1g即为目标产物(收率93.4%)。Rf=0.35(PE/EA=3:1)。LC-MS:m/z=239.05[M+H]+。
报道二、
步骤1:1-氨基-3-溴-5-甲氧基吡啶-1-鎓-2,4,6-三甲基苯磺酸盐:向冷却至0℃的O-(均三甲基苯磺酰基)羟胺(A部分,26.6 g,117 mmol)于二氯甲烷(570 mL)中的溶液中分批加入3-溴-5-甲氧基吡啶(22.1 g,117 mmol)。将反应混合物在0℃搅拌1h,然后用另外的3-溴-5-甲氧基吡啶(250 mg,1.39 mmol)处理,并在0℃再搅拌2h。将反应混合物用Et2O(600mL)稀释,在0℃下搅拌10min,然后真空过滤,并用Et2O(3×250 mL)冲洗。体积减少约1/3后,滤液产生另外的沉淀物,将其通过过滤收集。将两个滤饼真空干燥以提供标题化合物(39.3 g,83%产率)。1H NMR (CDCl3): δ 9.25 (br s, 1H), 8.99 (m, 1H), 8.74 (m,1H), 7.46 (m, 1H), 6.83 (s, 2H), 3.92 (s, 3H), 2.65 (s, 6H), 2.22 (s, 3H)。
步骤2:6-溴-4-甲氧基吡唑并[1,5-a]吡啶-3-甲酸乙酯和4-溴-6-甲氧基吡唑并[1,5-a]吡啶-3-甲酸乙酯:在环境温度下,向1-氨基-3-溴-5-甲氧基吡啶-1-鎓-2,4,6-三甲基苯磺酸盐(33.24 g,82.42 mmol)于DMF(82 mL)中的磁搅拌的白色悬浮液中加入TEA(22.98 mL,164.8 mmol),然后逐滴加入丙炔酸乙酯(16.71 mL,164.8 mmol)。剧烈搅拌2天后,通过分批加入到快速搅拌的冰水(820 mL)中将反应缓慢淬灭。将混合物在环境温度搅拌10分钟,然后真空过滤。用水冲洗收集的固体并风干,以约4∶1的比率(通过1H NMR)得到6-Br异构体为主要异构体的标题化合物(21g),为橙色固体。湿的固体异构体混合物(约75%w/w)不经进一步纯化直接用于步骤3。MS (apci) m/z = 298.9,300.9(M+H)。通过在1HNMR (CDCl3) 中的MeO化学位移δ3.98(6-Br异构体) vs. 3.83(4-Br异构体)确定区域异构体比率。
步骤3:6-溴-4-甲氧基吡唑并[1,5-a]吡啶(中间体1)和4-溴-6-甲氧基吡唑并[1,5-a]吡啶:在搅拌的同时将来自步骤2的6-溴-4-甲氧基吡唑并[1,5-a]吡啶-3-甲酸乙酯和4-溴-6-甲氧基吡唑并[1,5-a]吡啶-3-甲酸乙酯的异构体混合物 (15 g,50.1 mmol) 加入到48%HBr(114 mL)中,然后在80℃加热90min,然后在环境温度下搅拌过夜。将得到的悬浮液真空过滤并用水冲洗。将含水滤液和滤饼分别处理。将滤饼溶解在MTBE中并真空过滤以除去不溶性杂质。MTBE滤液经无水Na2SO4干燥,过滤并真空浓缩,得到为米色固体的6-溴-4-甲氧基吡唑并[1,5-a]吡啶(约98:2 6-/4- Br; 5.08 g)。MS (apci) m/z = 226.9, 228.9(M+H)。1H NMR (CDCl3): δ 8.26 (m, 1H), 7.82 (d, 1H), 6.61 (m, 1H), 6.43 (m,1H), 3.94 (s, 3H)。独立地,将原始含水反应混合物滤液用EtOAc(2×500 mL)萃取。将合并的有机萃取物干燥(Na2SO4),过滤并真空浓缩。将粗残余物溶于DCM(50 mL)中,然后过滤以除去不溶性固体。真空浓缩DCM滤液,然后进行硅胶色谱法(0至50%EtOAc/己烷),得到第二批为白色固体的6-溴-4-甲氧基吡唑并[1,5-a]吡啶(中间体1)(上部 Rf斑点,2.06 g),以及也为白色固体的次要异构体标题化合物4-溴-6-甲氧基吡唑并[1,5-a]吡啶(下部Rf斑点,1.32 g)。MS (apci) m/z = 226.9, 228.9 (M+H)。1H NMR (CDCl3): δ 8.02 (m, 1H),7.85 (d, 1H), 7.17 (d, 1H), 6.55 (m, 1H), 3.80 (s, 3H)。
步骤4:4-溴-6-甲氧基吡唑并[1,5-a]吡啶-3-甲醛:将4-溴-6-甲氧基吡唑并[1,5-a]吡啶(5.0 g,22 mmol)于DMF(220 mL)中的溶液冷却至0℃,然后用POCl3(6.2 mL,66mmol)缓慢处理。将反应温热至环境温度并搅拌过夜。将反应混合物冷却至0℃,用水(220mL)淬灭,并用6M NaOH(水溶液)碱化至pH 9-10。将反应混合物搅拌1小时,然后真空过滤。依次用水(3×50 mL)和MTBE(3×50 mL)冲洗固体。将收集的固体悬浮在DCM(500 mL)中,并在超声浴中搅拌30分钟,然后真空过滤。保留滤液,同时将滤饼溶于水(300 mL)中并用DCM萃取。合并有机萃取物和保留的DCM滤液,并用无水Na2SO4干燥,然后过滤并真空浓缩,得到标题化合物(4.84 g,86%收率)。MS (apci), m/z = 256.9 (M+H)。
步骤5:4-溴-6-甲氧基吡唑并[1,5-a]吡啶-3-甲醛肟:在环境温度下向4-溴6-甲氧基吡唑并[1,5-a]吡啶-3-甲醛(4.84 g,19.0 mmol)于EtOH(253 mL)中的悬浮液中添加水(127 mL)和盐酸羟胺(1.98 g,28.5 mmol)。在50℃下搅拌过夜后,将反应混合物冷却至环境温度并真空浓缩。将残余物悬浮在水(150 mL)中,然后用饱和NaHCO3(水溶液)(30 mL)缓慢淬灭。在环境温度下搅拌1小时后,将悬浮液真空过滤,并依次用H2O(500 mL)和MTBE(100mL)冲洗滤饼,得到标题化合物,为2:1 E/Z混合物(5.13 g,定量产率),将其不经进一步纯化用于下一步。MS (apci) m/z = 271.9 (M+H)。
步骤6:4-溴-6-甲氧基吡唑并[1,5-a]吡啶-3-甲腈:将4-溴-6-甲氧基吡唑并[1,5-a]吡啶-3-甲醛肟的E/Z混合物(4.95 g,18.33 mmol)在乙酸酐(172.9 mL,1833 mmol)中在140℃下搅拌25h,然后冷却至环境温度。将得到的悬浮液在冰浴中进一步冷却15分钟,然后真空过滤并依次用水(200 mL)和MTBE(300 mL)冲洗以提供标题化合物(3.74 g,81%产率)。1H NMR (d6-DMSO): δ 8.70 (s, 1H), 8.60 (s, 1H), 7.78 (s, 1H), 3.83 (s,3H)。
步骤7:6-溴-4-羟基吡唑并[1,5-A]吡啶-3-甲腈:4-溴-6-甲氧基吡唑并[1,5-a]吡啶-3-甲腈(50.0 g,198.4 mmol)于DCE(500 mL)中的浆料用AlCl3(79.34 g,595.1mmol)处理。在N2(g)气氛下,将所得混合物在76℃下搅拌19h,然后冷却至室温。使用THF(1750 mL)作为冲洗溶剂,将反应混合物倒入机械搅拌的十水硫酸钠(10 eq,639 g)于THF(1000 mL)中的悬浮液中。在环境温度下搅拌过夜后,将得到的悬浮液过滤,并将固体用另外的THF(2×250 mL)冲洗。将滤液在真空中浓缩,并将得到的固体在高真空下干燥3天,以足够的纯度提供标题化合物(46.18 g,98%产率)用于后续使用。1H NMR (d6-DMSO): δ10.48 (s, 1H), 8.58 (s, 1H), 8.38 (d, 1H), 7.64 (3, 1H)。
参考文献
[1] [中国发明] CN201911244557.9 RET抑制剂、其药物组合物及其用途
[2] [中国发明] CN201880065866.7 包含6-(2-羟基-2-甲基丙氧基)-4-(6-(6-((6-甲氧基吡啶-3-基)甲基)-3,6-二氮杂双环[3.1.1]庚-3-基)吡啶-3-基)吡唑并[1,5-a]吡啶-3-甲腈的制剂
